产品分类
公司荣誉
公司图片
联系方式
公司新闻
自身免疫疾病和风湿免疫病诊断自身抗体标志物筛选
发布时间:2019-02-19 12:01 | 点击次数:
ADREAM(Autoimmune Disease and Rheumatic disease Early-diagnosis Autoantibody bioMarker Screening)
摘要:
疾病标志物具有重要的临床诊断价值和基础研究价值。博翀生物 ADREAM 项目,旨在为临床和基础医学专家提供「自身免疫疾病&风湿免疫疾病」蛋白标志物筛选和验证的整体科研服务。ADREAM 项目基于 HuProt™ 人类全蛋白质组芯片以及博翀生物成熟的蛋白质芯片技术服务平台和实践经验,以系统性筛选、发现、建立和验证各种免疫类疾病的血清学自身抗体或组合为方法学,建立基于大样本量具有统计学意义和临床应用价值的血清学标志性/特异性/相关性/预警性的自身抗体疾病标志物。
关键词:自身免疫疾病&风湿免疫疾病,HuPro™ 人蛋白组芯片,自身抗体标志物
疾病标志物是疾病在生命微观世界的体现者,具有重要的临床诊断价值和基础研究价值,因此受到广泛的重视和开发,尤其肿瘤标志物和各种重大慢病标志物的开发。标志物的类型可以分为 DNA/RNA 类型的标志物,蛋白类型的标志物和代谢物类型的标志物。蛋白是基因和环境互作的直接体现者,蛋白标志物是一类非常有潜力的生物标志物,因此其发现和鉴定工作会持续是检测领域热点。
ADREAM 计划是博翀生物基于 2017 年《肿瘤早诊特异自身抗体标志物筛选 TEAMS 计划》实战经验之后规划的又一转化医学整体科研服务项目。该项目以自身免疫病和风湿免疫病为项目切入点,基于 HuProt™ 人类全蛋白质组芯片以及博翀生物公司成熟的蛋白质芯片技术服务平台和实践经验,同国内医院、研究院所和高校等相关领域的临床科研专家进行合作,以系统性的筛选、发现、建立和验证一系列自身免疫疾病和风湿免疫病的血清学自身抗体或组合,并通过相近类型疾病的联合检测验证分析,建立基于大样本量具有统计学意义和临床应用价值的特异性标志物。
1. 身免疫疾病和风湿免疫疾病概述
自身免疫疾病和风湿免疫疾病都是因免疫系统异常从而致使组织或功能异常的免疫类疾病,因此我们统称自免病。根据风湿协会和自身免疫病协会公布的近 200 种病种(www.aarda.org 和 www.rheumatology.org),可粗略将自免病分为八大类:(1)风湿免疫病,如类风湿性关节炎;(2)神经系统相关疾病,如老年痴呆症;(3)消化系统相关疾病,如自身免疫性肝炎;(4)呼吸系统相关疾病,如间质性肺病;(5)自身免疫皮肤病,如硬化症;(6)心血管相关疾病,如抗磷脂综合症;(7)内分泌系统相关疾病,如甲亢;和(8)类自免病,如子痫前症。
自免病的发病因素包括遗传因素和环境因素 1,2,如自免病会在家族中聚集发生,缺碘饮食引发甲亢疾病。自免病发病的机理是遗传和环境相互作用最终致使免疫耐受平衡被破坏 2,导致机体免疫效应细胞或分子针对自身组织或细胞的自身抗原产生病理性免疫反应 3,最终导致自免病临床症状的发生(图 1)。
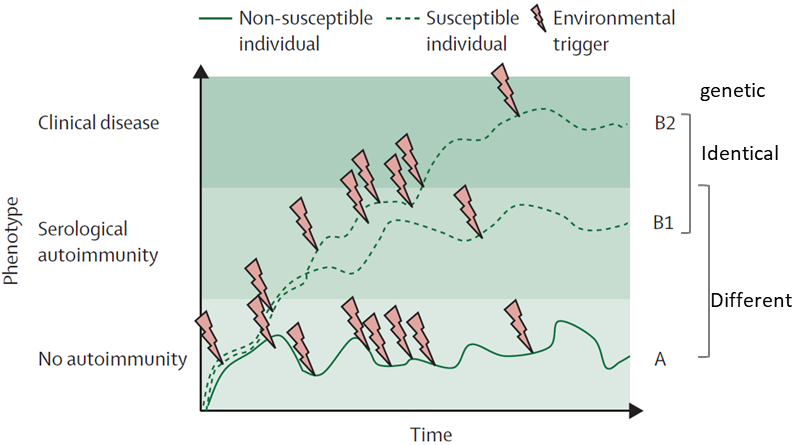
图 1. 自免病的发病机理 2。自免病是遗传和环境相互作用的结果,遗传易感人群(B1 和 B2)在遇到压力、激素、食物抗原、吸烟等环境因子的长时间刺激诱导的情况下,会诱发自免病的发生(B2);而非易感人群(A)在类似同样的环境中,则不会发生自免病。而伴随自免病发生发展过程的血清中自身抗体产生是遗传和环境综合作用的结果。
自免病的共同特点包括(1)受累组织不同,临床表现错综复杂;(2)病程慢病迁延反复;(3)治疗可以使用激素免疫抑制剂缓解,(4)女性患病风险普遍比男性高。自免病患病率高,且部分自免病(如重症肌无力、毒性弥漫性甲状腺肿、天疱疮、新生儿狼疮皮疹)可以通过胎盘传递给胎儿,给家庭和社会造成严重困扰,包括致残(Disability),痛苦(Discomfort),死亡(Death),经济损失(Dollar lost)和药物中毒(Drug toxicity),因此自免病俗称「5D」病。自免病发展快,病种多,误诊误治多耽误最佳治疗时机。因此自免病的早期诊断、早期治疗对减缓病程进展、减少组织器官不可逆损伤、提高患者生活质量至关重要。
自身免疫抗体是自免病最重要的特征之一,其特征性的自身抗体(谱)可以用来标志特种自免病,且自身抗体可在发病前数年出现在血液中 4-6,因此可用来对自免病进行鉴别诊断,预警预防,病情评估治疗检测,病程转归预后判断。但自免病是一种非典型的遗传性疾病,其自身抗体复杂多样。目前已经研发应用于临床检测的自身抗体,在临床检测实践应用中存在主要问题包括(1)自身抗体检查项目的选择困难,(2)检测结果与临床表现的解释困惑。其主要原因是疾病特异性抗体种类较少,疾病非特异性自身抗体和生理性自身抗体的干扰,假阴性和假阳性自身抗体检测结果的评价。
因此,自免病免疫血清学诊断需要加强疾病标志性、特异性、相关性、预警性自身抗体(谱)的研发和推广应用,并在临床检测应用中建立自身抗体检测的标准化操作指南和质量控制评价体系,从而最终提高自免病的诊治水平。
2. 自身抗体标志物研究方法概述
自身抗体由其识别的抗原进行定义,因此筛选自身抗体的方法本质上是抗原库的制备和免疫筛选方法的建立。目前自身抗体检测的主要方法包括 cDNA 文库血清筛选 SEREX 法,质谱蛋白组学检测技术和蛋白质组芯片技术(表 1)。
① SEREX (SERological analysis of tumor antigens by recombinant cDNA EXpression cloning) 方法是早期研究和发现自身抗体的经典方法 17,其方法策略是基于病人组织获得总 RNA,建立 cDNA 细菌文库诱导表达重组蛋白制备抗原库;然后将抗原库转移到膜上使用病人血清进行免疫检测,最后阳性克隆通过测序获得抗原信息 18。目前 SEREX 技术已用于肿瘤和自免病标志物的筛选 19,如自身免疫疾病系统性红斑狼疮 20、干燥综合症 21 和类风湿性关节炎 22。该方法主要不足:(1)cDNA 建库丰度不均衡,低丰度蛋白难以检测;(2)cDNA 建库材料需要明确的组织样本,肿瘤样本容易获取,但自身免疫疾病患者的组织样本来源困难,同时免疫检测需求的血清量较多;(3)实验过程繁多技术要求高,不适宜大量样本的筛选。
② 质谱蛋白组学检测技术是将蛋白的各项分离技术和质谱检测技术进行串联使用发现疾病相关标志物 (图 2),包括 SERPA (SERological Proteome Analysis) 和 ITRAQ-SRM 联合检测技术 23,24。SERPA 是利用双向电泳联合质谱法筛选鉴定差异蛋白的经典方法,主要基于组织或细胞裂解液经过双向电泳分离制备抗原库,然后通过血清免疫印迹发现阳性或差异蛋白,最后通过质谱鉴定 25,26,该方法最大优势是基于天然样本而非重组蛋白的免疫印迹,能够最大程度的还原免疫原,但是同样存在蛋白丰度不均和低丰度蛋白无法检出的问题,而且技术要求性强实验重复性差。随着质谱检测技术升级,新近发展的 ITRAQ-PRM 质谱技术则是一种不依赖电泳分离技术直接进行差异蛋白发现和验证的精准检测技术,并应用到疾病标志物的发现和验证。质谱法无法检测和识别抗体,目前筛选标志物主要适用于组织样本中差异蛋白的检测和血清学中抗原和残留肽段标志物的发现验证 27,28。前者筛选标志物更多针对的是组织样本或细胞系中的差异蛋白,这些差异蛋白最终要回归到血清等组织液中进行再验证才能达到血液检测临床应用的价值,很多的差异蛋白无法通过二次验证导致标志物筛选失败。后者则血清中抗原或残留肽段含量极低,因需要极高的检测灵敏度,该方法对设备要求极高,实验操作复杂且价格昂贵,不适宜大样本验证和大规模推广检测。
自免病的共同特点包括(1)受累组织不同,临床表现错综复杂;(2)病程慢病迁延反复;(3)治疗可以使用激素免疫抑制剂缓解,(4)女性患病风险普遍比男性高。自免病患病率高,且部分自免病(如重症肌无力、毒性弥漫性甲状腺肿、天疱疮、新生儿狼疮皮疹)可以通过胎盘传递给胎儿,给家庭和社会造成严重困扰,包括致残(Disability),痛苦(Discomfort),死亡(Death),经济损失(Dollar lost)和药物中毒(Drug toxicity),因此自免病俗称「5D」病。自免病发展快,病种多,误诊误治多耽误最佳治疗时机。因此自免病的早期诊断、早期治疗对减缓病程进展、减少组织器官不可逆损伤、提高患者生活质量至关重要。
自身免疫抗体是自免病最重要的特征之一,其特征性的自身抗体(谱)可以用来标志特种自免病,且自身抗体可在发病前数年出现在血液中 4-6,因此可用来对自免病进行鉴别诊断,预警预防,病情评估治疗检测,病程转归预后判断。但自免病是一种非典型的遗传性疾病,其自身抗体复杂多样。目前已经研发应用于临床检测的自身抗体,在临床检测实践应用中存在主要问题包括(1)自身抗体检查项目的选择困难,(2)检测结果与临床表现的解释困惑。其主要原因是疾病特异性抗体种类较少,疾病非特异性自身抗体和生理性自身抗体的干扰,假阴性和假阳性自身抗体检测结果的评价。
因此,自免病免疫血清学诊断需要加强疾病标志性、特异性、相关性、预警性自身抗体(谱)的研发和推广应用,并在临床检测应用中建立自身抗体检测的标准化操作指南和质量控制评价体系,从而最终提高自免病的诊治水平。
2. 自身抗体标志物研究方法概述
自身抗体由其识别的抗原进行定义,因此筛选自身抗体的方法本质上是抗原库的制备和免疫筛选方法的建立。目前自身抗体检测的主要方法包括 cDNA 文库血清筛选 SEREX 法,质谱蛋白组学检测技术和蛋白质组芯片技术(表 1)。
① SEREX (SERological analysis of tumor antigens by recombinant cDNA EXpression cloning) 方法是早期研究和发现自身抗体的经典方法 17,其方法策略是基于病人组织获得总 RNA,建立 cDNA 细菌文库诱导表达重组蛋白制备抗原库;然后将抗原库转移到膜上使用病人血清进行免疫检测,最后阳性克隆通过测序获得抗原信息 18。目前 SEREX 技术已用于肿瘤和自免病标志物的筛选 19,如自身免疫疾病系统性红斑狼疮 20、干燥综合症 21 和类风湿性关节炎 22。该方法主要不足:(1)cDNA 建库丰度不均衡,低丰度蛋白难以检测;(2)cDNA 建库材料需要明确的组织样本,肿瘤样本容易获取,但自身免疫疾病患者的组织样本来源困难,同时免疫检测需求的血清量较多;(3)实验过程繁多技术要求高,不适宜大量样本的筛选。
② 质谱蛋白组学检测技术是将蛋白的各项分离技术和质谱检测技术进行串联使用发现疾病相关标志物 (图 2),包括 SERPA (SERological Proteome Analysis) 和 ITRAQ-SRM 联合检测技术 23,24。SERPA 是利用双向电泳联合质谱法筛选鉴定差异蛋白的经典方法,主要基于组织或细胞裂解液经过双向电泳分离制备抗原库,然后通过血清免疫印迹发现阳性或差异蛋白,最后通过质谱鉴定 25,26,该方法最大优势是基于天然样本而非重组蛋白的免疫印迹,能够最大程度的还原免疫原,但是同样存在蛋白丰度不均和低丰度蛋白无法检出的问题,而且技术要求性强实验重复性差。随着质谱检测技术升级,新近发展的 ITRAQ-PRM 质谱技术则是一种不依赖电泳分离技术直接进行差异蛋白发现和验证的精准检测技术,并应用到疾病标志物的发现和验证。质谱法无法检测和识别抗体,目前筛选标志物主要适用于组织样本中差异蛋白的检测和血清学中抗原和残留肽段标志物的发现验证 27,28。前者筛选标志物更多针对的是组织样本或细胞系中的差异蛋白,这些差异蛋白最终要回归到血清等组织液中进行再验证才能达到血液检测临床应用的价值,很多的差异蛋白无法通过二次验证导致标志物筛选失败。后者则血清中抗原或残留肽段含量极低,因需要极高的检测灵敏度,该方法对设备要求极高,实验操作复杂且价格昂贵,不适宜大样本验证和大规模推广检测。
表 1. 自免病自身抗体筛选方法文献实例部分汇总
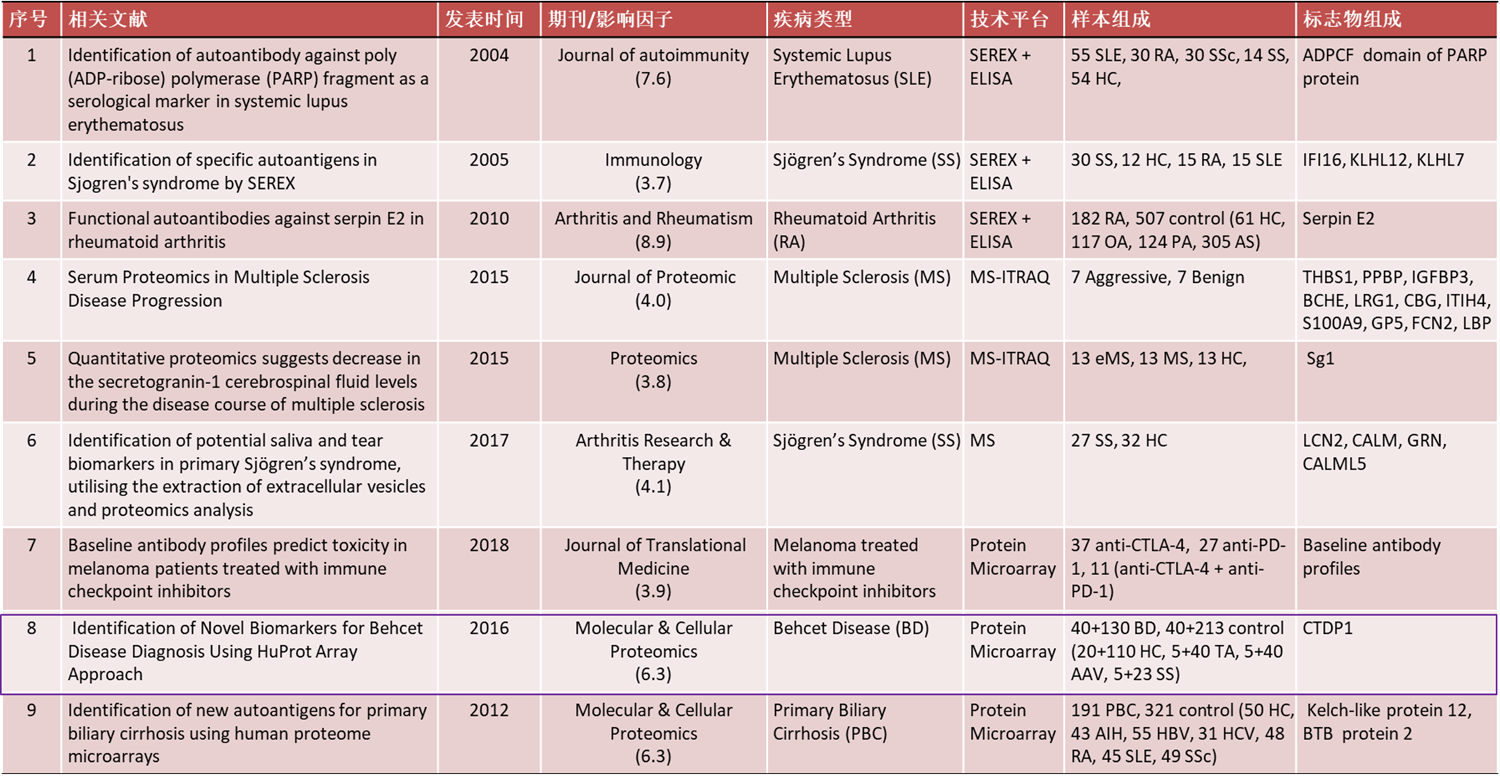

注:8 号文献的样本组成包括 2 部分:白塞病自身抗体标志物发现阶段的检测样本+验证阶段的验证样本。
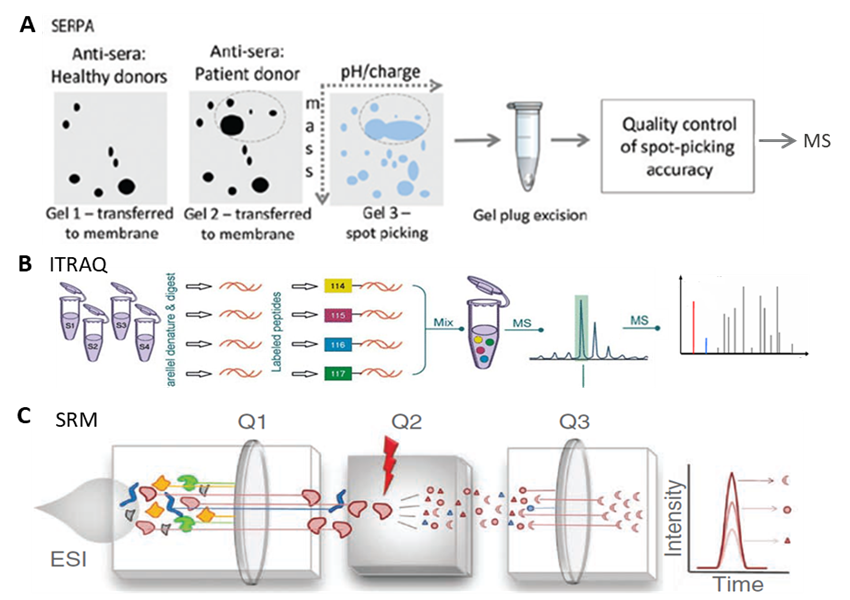
图 2. 基于质谱法的标志物筛选方法 SERPA23, ITRAQ-SRM24 方法示意图。A) SERPA 法通过双向电泳制备组织样本的抗原库,然后通过疾病组和健康组的血清筛选差异自身抗体,最后质谱鉴定抗原。B) ITRAQ 技术则是直接检测健康组和对照组的差异蛋白,然后通过 C)SRM 技术对特定差异蛋白进行大样本检测验证,ITRAQ-SRM 法适用于尿液、唾液、细胞上清液、血液样本检测,但大样本验证和血清痕量抗原检测不具优势。
③ Protein microarray 蛋白质芯片技术,根据抗原库来源不同分为两种形式:抗体芯片和重组蛋白芯片。抗体芯片即反向蛋白芯片,是将抗体固定于基片表面,因抗体芯片的组学通量受限于抗体的个数和质量,在蛋白标志物组学抗原筛选上不具优势,其优势应用在于基础研究的具体信号通路差异或者临床多种疾病已知标志物组合的检测上。而重组蛋白质芯片,即将确定的重组蛋白直接固定于芯片表面作为抗原库,进而进行血清学自身抗体差异筛选,这是最直接的一种方式,同时满足高通量和大量样本筛选的需求。但是获得足够多种类的重组蛋白是一个挑战。而包含~20000 个重组蛋白,涵盖~75% 的人类蛋白质组的 HuProt™ 人类全蛋白质组芯片产品正是用于自身抗体发现的理想工具 29,30。HuProt™ 人类全蛋白质组芯片是最早由美国 Johns Hopkins 大学高通量中心的朱衡教授开发 31,是目前为止最高通量的蛋白质组芯片,涵盖人类重组蛋白~20,000 个 (图 3)。蛋白质大部分是基因全长序列,部分是不同剪切体形式,通过高通量重组蛋白质制备方式获得,表达宿主是酵母,纯化方式为 GST 标签亲和纯化。该款蛋白质芯片已应用于原发性胆汁性肝硬化 32、神经精神性红斑狼疮 33,白塞病 34,等自身免疫性疾病,以及胃癌 35 等恶性肿瘤的生物标志物发现。
③ Protein microarray 蛋白质芯片技术,根据抗原库来源不同分为两种形式:抗体芯片和重组蛋白芯片。抗体芯片即反向蛋白芯片,是将抗体固定于基片表面,因抗体芯片的组学通量受限于抗体的个数和质量,在蛋白标志物组学抗原筛选上不具优势,其优势应用在于基础研究的具体信号通路差异或者临床多种疾病已知标志物组合的检测上。而重组蛋白质芯片,即将确定的重组蛋白直接固定于芯片表面作为抗原库,进而进行血清学自身抗体差异筛选,这是最直接的一种方式,同时满足高通量和大量样本筛选的需求。但是获得足够多种类的重组蛋白是一个挑战。而包含~20000 个重组蛋白,涵盖~75% 的人类蛋白质组的 HuProt™ 人类全蛋白质组芯片产品正是用于自身抗体发现的理想工具 29,30。HuProt™ 人类全蛋白质组芯片是最早由美国 Johns Hopkins 大学高通量中心的朱衡教授开发 31,是目前为止最高通量的蛋白质组芯片,涵盖人类重组蛋白~20,000 个 (图 3)。蛋白质大部分是基因全长序列,部分是不同剪切体形式,通过高通量重组蛋白质制备方式获得,表达宿主是酵母,纯化方式为 GST 标签亲和纯化。该款蛋白质芯片已应用于原发性胆汁性肝硬化 32、神经精神性红斑狼疮 33,白塞病 34,等自身免疫性疾病,以及胃癌 35 等恶性肿瘤的生物标志物发现。
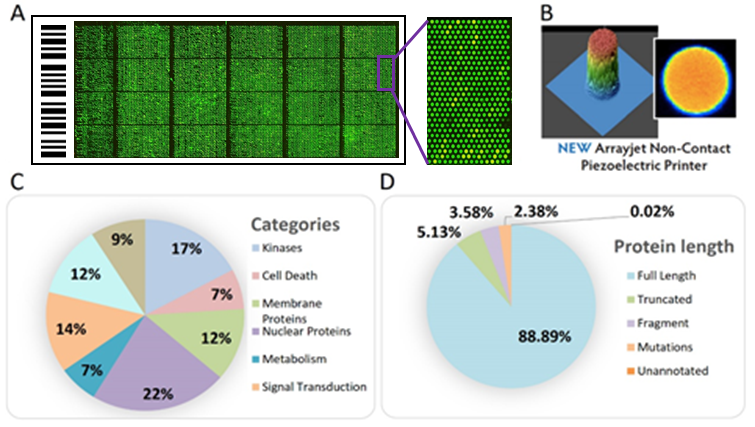
图 3. HuProt™ 人类全蛋白质组芯片。A) 芯片质控图片,使用 anti-GST 孵育检测;芯片共有 24 个阵列,包含人类重复蛋白 19,394 个,每个蛋白重复 2 点。B) 芯片制备采用先进的非接触式点样系统,点样非常均匀。C) 蛋白质按照种类归类分析。D) 蛋白质按照长度归类分析,其中大部分蛋白质为全长表达(88.9%)。
该芯片自 2014 年开始商业化,经美国 CDI Laboratory 公司升级、改造,从蛋白浓度、基片、点样方式等进行了一系列优化并实现了批量生产,目前最新版本是 HuProt™ 3.1 版。2017 年我们利用 HuProt™ 人类全蛋白质组芯片已经开展肿瘤自身抗体标志物筛选 TEAMS 项目,联合了复旦大学附属中山医院、复旦大学附属肿瘤医院、上海交大附属瑞金医院、上海市肺科医院、郑州大学附属第一医院、中山大学附属佛山医院、深圳人民医院等单位针对肝癌、肺癌、胃癌、食管癌等 10 种肿瘤进行系统性、多方位的全面自身抗体标志物筛选,取得多方面重大突破。TEAMS 项目的开展和实施使得博翀生物蛋白质芯片平台进行全面升级,并积累大量的标志物整体实验和数据分析等实践经验,也为 ADREAM 计划开展打下了良好的基础。而今我们乘势进行更大范围的自免病标志物筛选 ADREAM 计划,在自免病自身抗体标志物筛选和应用的临床转化医学进展过程中是一次很好的实践和责任担当。
3. ADREAM 项目
根据自免病分类和蛋白芯片筛选自身抗体标志物方案整体特点,博翀生物将 ADREAM 项目分为八大分支(图 4),具体项目实施将以客户为中心进行开展。
该芯片自 2014 年开始商业化,经美国 CDI Laboratory 公司升级、改造,从蛋白浓度、基片、点样方式等进行了一系列优化并实现了批量生产,目前最新版本是 HuProt™ 3.1 版。2017 年我们利用 HuProt™ 人类全蛋白质组芯片已经开展肿瘤自身抗体标志物筛选 TEAMS 项目,联合了复旦大学附属中山医院、复旦大学附属肿瘤医院、上海交大附属瑞金医院、上海市肺科医院、郑州大学附属第一医院、中山大学附属佛山医院、深圳人民医院等单位针对肝癌、肺癌、胃癌、食管癌等 10 种肿瘤进行系统性、多方位的全面自身抗体标志物筛选,取得多方面重大突破。TEAMS 项目的开展和实施使得博翀生物蛋白质芯片平台进行全面升级,并积累大量的标志物整体实验和数据分析等实践经验,也为 ADREAM 计划开展打下了良好的基础。而今我们乘势进行更大范围的自免病标志物筛选 ADREAM 计划,在自免病自身抗体标志物筛选和应用的临床转化医学进展过程中是一次很好的实践和责任担当。
3. ADREAM 项目
根据自免病分类和蛋白芯片筛选自身抗体标志物方案整体特点,博翀生物将 ADREAM 项目分为八大分支(图 4),具体项目实施将以客户为中心进行开展。

图 4. ADREAM 项目构成。根据自免病的分类和自身抗体标志物筛选方案的整体特点,博翀生物将 ADREAM 项目分为八大分支,包括 ADREAM-风湿免疫病、神经系统疾病、消化系统疾病、心血管系统疾病、呼吸系统疾病、皮肤性疾病、内分泌系统疾病和类自免病疾病。每个 ADREAM 分支都以相近类型疾病进行归类和联合分析,图示的每一个分支都只列举部分代表性的疾病,实际 ADREAM 计划将以客户需求为中心进行联合自免病标志物自身抗体的发现和验证工作。以 ADREAM-风湿免疫疾病分支的开发研究为例,该计划以所有的风湿免疫疾病(41 种)为研究对象,重点覆盖弥漫系统性风湿免疫疾病的自身诊断标志物筛选。标志物发现阶段每个疾病单独进行,联合重点在验证阶段,以干燥综合症为例,在验证阶段采用横向(健康对照)和纵向(联合其它风湿免疫病筛选结果)2 个维度的数据比对,以获得干燥综合症特异诊断标志物组合;同时每个自免病标志物组合与目前主要的自身抗体诊断方式联合,以期获得最优诊断效果。ADREAM 项目的每一个疾病研究亦然。这八大 ADREAM 分支计划几乎涵盖所有自免病范畴,每一个 ADREAM 分支仅列举部分代表性的自免病,而每一个分支项目都可以根据客户研究的需求进行联合和筛选特异自身抗体。
3.1 项目方案
ADREAM 项目实施,以 ADREAM-风湿免疫病分支为例说明,ADREAM-风湿免疫病分支以所有风湿免疫疾病为研究对象,重点覆盖弥漫系统性风湿免疫疾病的自身诊断标志物筛选。ADREAM 项目方案以发现和建立全新的标志物组合,同时联合目前的方法或标志物建立组合为切入点,基于 HuProt™ 人类全蛋白质组芯片(~20,000 个人重组蛋白)和文献报道的自身抗体,利用博翀公司标准化的蛋白质芯片服务平台进行(1)自免病标志物发现和(2)大规模样本验证,其自身抗体标志物组合进行 ROC 曲线(经独立验证评价)。针对具体的风湿免疫疾病标志物筛选,以干燥综合症为例,进行详细说明。
3.1.1 实验原理
蛋白质芯片作为抗原库直接进行血清学筛选,可同时检测两种抗体亚型(IgG 和 IgM,或其它亚型抗体)的结合情况,然后使用两种不同荧光标记的特异性二抗进行血清中差异自身抗体的鉴定(图 5)。
3.1 项目方案
ADREAM 项目实施,以 ADREAM-风湿免疫病分支为例说明,ADREAM-风湿免疫病分支以所有风湿免疫疾病为研究对象,重点覆盖弥漫系统性风湿免疫疾病的自身诊断标志物筛选。ADREAM 项目方案以发现和建立全新的标志物组合,同时联合目前的方法或标志物建立组合为切入点,基于 HuProt™ 人类全蛋白质组芯片(~20,000 个人重组蛋白)和文献报道的自身抗体,利用博翀公司标准化的蛋白质芯片服务平台进行(1)自免病标志物发现和(2)大规模样本验证,其自身抗体标志物组合进行 ROC 曲线(经独立验证评价)。针对具体的风湿免疫疾病标志物筛选,以干燥综合症为例,进行详细说明。
3.1.1 实验原理
蛋白质芯片作为抗原库直接进行血清学筛选,可同时检测两种抗体亚型(IgG 和 IgM,或其它亚型抗体)的结合情况,然后使用两种不同荧光标记的特异性二抗进行血清中差异自身抗体的鉴定(图 5)。
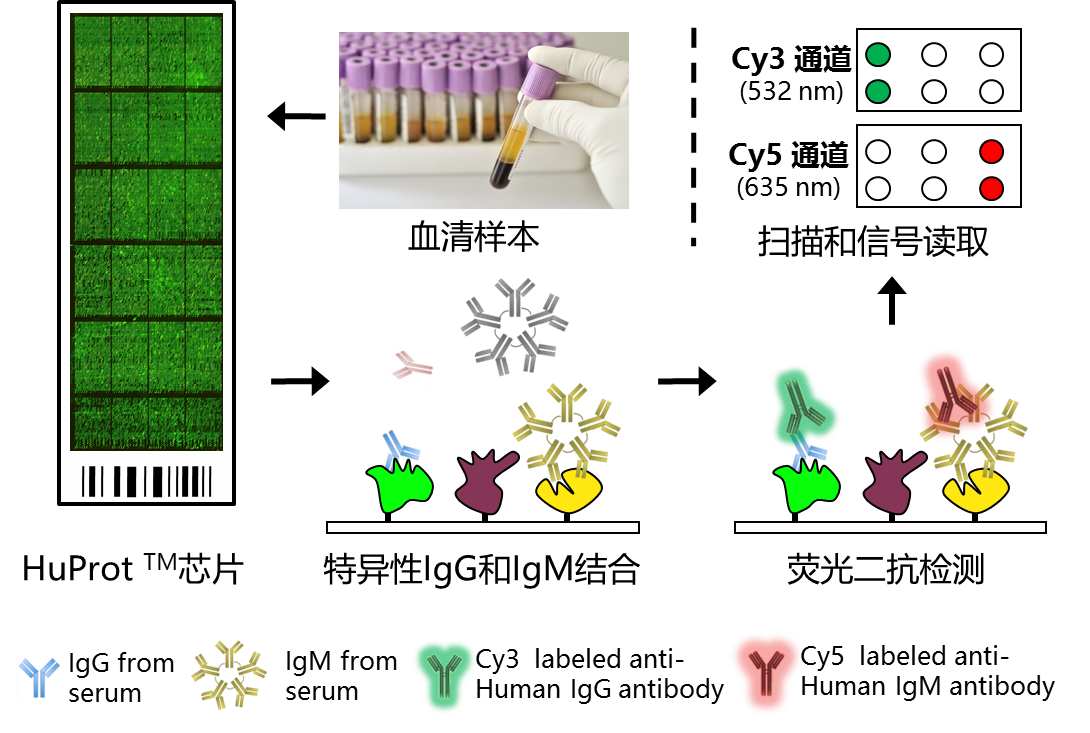
图 5. ADREAM 项目实验原理示意图。每个血清样本,使用 1 张 HuProtTM 蛋白质芯片进行检测,血清中的特异抗体(包括 IgG 和 IgM,或其它亚型抗体)与固定于芯片上的蛋白进行结合,清洗去除未结合的抗体和其它蛋白质,再用抗人 IgM 荧光标记二抗(cy5 标记,呈现红色)和抗人 IgG 荧光二抗(cy3 标记,呈现绿色)检测,通过荧光扫描仪读取信号,信号的强弱与抗体的亲和力和数量呈正相关。
3.1.2 详细方案
ADREAM 项目方案包括第一阶段标志物筛选和第二阶段标志物验证。第一阶段各个疾病的标志物筛选实验单独同期进行。第二阶段标志物验证采用横向(健康对照)和纵向(联合的其它风湿免疫病)验证获取干燥综合症特异标志物。
第一阶段:HuProt™ 人类全蛋白质组芯片筛选(Discovery Phage)
使用涵盖~20,000 个人类重组蛋白的 HuProt™ Proteome Microarray 进行初步筛选,以发现具有一定差异的潜在的自身抗原库(图 6)。实施具体方案:
样本设置:
干燥综合症组:15 例;要求:典型的病例样本;明确的临床诊断结论;样本保存完好(-80 度保存);完善度临床信息(优先选初治病人);
健康对照组:15 例;要求:整体的性别、年龄同疾病组匹配;样本保存完好。
每 3 个样本混合使用一张芯片,共 10 张芯片。
数据分析:
按照以下标准确定候选标志物:1) P 值<0.05;2) 阳性率在疾病组一致性或显著高于健康对照组(按照 cutoff 值,健康组阳性率<10%; 疾病组阳性率>30%)。候选标志物个数选择约 50 个(按照优先级排序)。
3.1.2 详细方案
ADREAM 项目方案包括第一阶段标志物筛选和第二阶段标志物验证。第一阶段各个疾病的标志物筛选实验单独同期进行。第二阶段标志物验证采用横向(健康对照)和纵向(联合的其它风湿免疫病)验证获取干燥综合症特异标志物。
第一阶段:HuProt™ 人类全蛋白质组芯片筛选(Discovery Phage)
使用涵盖~20,000 个人类重组蛋白的 HuProt™ Proteome Microarray 进行初步筛选,以发现具有一定差异的潜在的自身抗原库(图 6)。实施具体方案:
样本设置:
干燥综合症组:15 例;要求:典型的病例样本;明确的临床诊断结论;样本保存完好(-80 度保存);完善度临床信息(优先选初治病人);
健康对照组:15 例;要求:整体的性别、年龄同疾病组匹配;样本保存完好。
每 3 个样本混合使用一张芯片,共 10 张芯片。
数据分析:
按照以下标准确定候选标志物:1) P 值<0.05;2) 阳性率在疾病组一致性或显著高于健康对照组(按照 cutoff 值,健康组阳性率<10%; 疾病组阳性率>30%)。候选标志物个数选择约 50 个(按照优先级排序)。
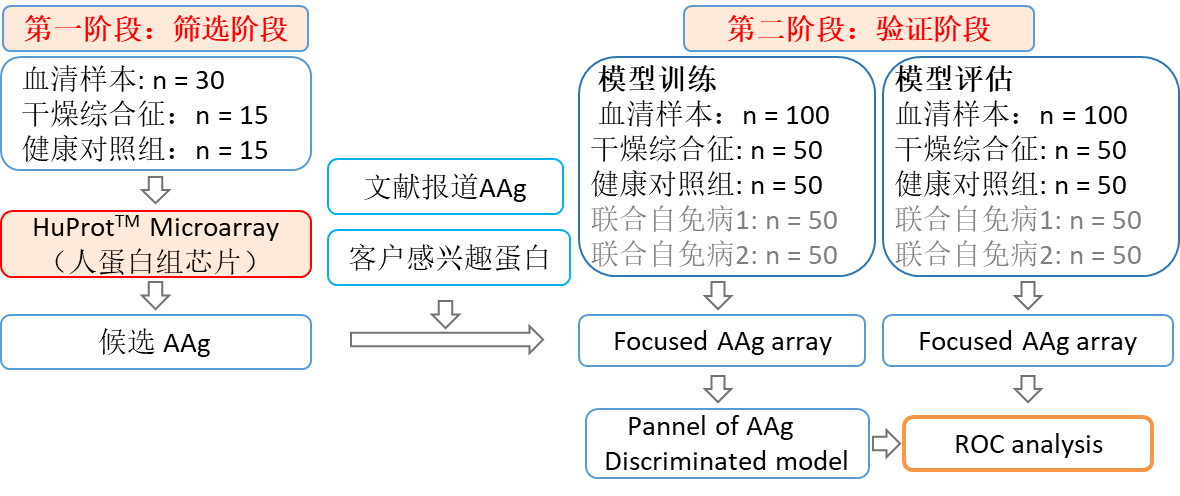
图 6. ADREAM 项目方案实施路线图。1)第一阶段标志物筛选: 使用 HuProt™ 人类全蛋白质组芯片进行初筛,以干燥综合症病研究为例,疾病组和健康对照组样本各 15 例,每 3 例样本进行混样芯片检测;该阶段联合的各个疾病项目单独同期进行。2)候选标志物抗原,联合汇总文献中比较好的自身抗体的抗原(AAg)或客户感兴趣的蛋白,进行蛋白小芯片(Focus AAg Array)制备,此阶段项目联合的每个疾病 AAg 集中点制在该蛋白小芯片上,因此小芯片制备需要第一阶段所有联合的项目结束后进行;3)第二阶段大样本验证标志物: 每个疾病 100 例样本进行检测验证,然后建立模型,模型训练和评估,首先模型训练以获得能够区分健康对照、干燥综合症、其它风湿免疫病对照的特异性标志物组合以及模型;然后模型评估采用独立样本进行客观评价,最佳标志物组合数据进行 ROC 评价。
第二阶段:使用定制小芯片进行大样本验证(Validation Phase)
通过蛋白质芯片筛选获得的初步候选的自身抗原库,连同文献报道的自身抗体,以及其它联合的自身免疫抗体,一并构建定制小芯片(Focused AAg Array),然后进行联合项目各个疾病的大样本检测(图 6),每 12 例样本对应 1 张芯片(12 个重复阵列小芯片),并获得所有响应数据。实施具体方案:
样本设置:
干燥综合症组:100 例;健康对照组:100 例。疾病和健康组样本要求同上;100 例样本也可包含初筛的各 15 例再检测(不建议)。
联合自免病对照组:100 例*(N-1)(如果 N 个风湿免疫病进行联合检测,那么第二阶段的数据将对其它联合的自免病自身抗体进行特异性识别,届时将产生 N 个联合疾病的标志物特异性数据;如果单独检测,则无联合自免病的对照组)。
数据分析:
随机选择 100 例(50 疾病/50 对照)样本进行模型训练(training),建立干燥综合症自身抗体组合的特异辨别模型;利用其余样本数据进行模型评估(test),直接评价其特异性和灵敏度;同时利用联合自免病产生的特异性数据,进行疾病间标志物特异性和灵敏性评价。最后利用模型获取的最佳数据进行 ROC 评价。
◇ Reference
1. Castiblanco, J., Arcos-Burgos, M. & Anaya, J. M. What is next after the genes for autoimmunity? BMC Med 11, 197, doi:10.1186/1741-7015-11-197 (2013).
2. Wahren-Herlenius, M. & Dorner, T. Immunopathogenic mechanisms of systemic autoimmune disease. Lancet (London, England) 382, 819-831, doi:10.1016/s0140-6736(13)60954-x (2013).
3. Theofilopoulos, A. N., Kono, D. H. & Baccala, R. The multiple pathways to autoimmunity. Nature immunology 18, 716-724, doi:10.1038/ni.3731 (2017).
4. Arbuckle, M. R. et al. Development of autoantibodies before the clinical onset of systemic lupus erythematosus. The New England journal of medicine 349, 1526-1533, doi:10.1056/NEJMoa021933 (2003).
5. Metcalf, J. V. et al. Natural history of early primary biliary cirrhosis. Lancet (London, England) 348, 1399-1402, doi:10.1016/s0140-6736(96)04410-8 (1996).
6. Majka, D. S. et al. Duration of preclinical rheumatoid arthritis-related autoantibody positivity increases in subjects with older age at time of disease diagnosis. Annals of the rheumatic diseases 67, 801-807, doi:10.1136/ard.2007.076679 (2008).
7. Sherer, Y., Gorstein, A., Fritzler, M. J. & Shoenfeld, Y. Autoantibody explosion in systemic lupus erythematosus: more than 100 different antibodies found in SLE patients. Seminars in arthritis and rheumatism 34, 501-537 (2004).
8. Hu, C. J., Zhang, F. C., Li, Y. Z. & Zhang, X. Primary biliary cirrhosis: what do autoantibodies tell us? World journal of gastroenterology 16, 3616-3629 (2010).
9. Shoenfeld, Y., Twig, G., Katz, U. & Sherer, Y. Autoantibody explosion in antiphospholipid syndrome. Journal of autoimmunity 30, 74-83, doi:10.1016/j.jaut.2007.11.011 (2008).
10. Leung, P. S. et al. Antimitochondrial antibodies in acute liver failure: implications for primary biliary cirrhosis. Hepatology 46, 1436-1442, doi:10.1002/hep.21828 (2007).
11. Bassyouni, I. H., Ezzat, Y., Hamdy, S. & Talaat, R. M. Clinical significance of anti-cyclic citrullinated peptide antibodies in Egyptian patients with chronic hepatitis C virus genotype IV infection. Clinical chemistry and laboratory medicine 47, 842-847, doi:10.1515/CCLM.2009.189 (2009).
12. 中华医学会风湿病学分会. 系统性红斑狼疮诊断及治疗指南中华医学会风湿病学分会. 中华风湿病学杂志 14 (2010).
13. 中华医学会风湿病学分会. 类风湿关节炎诊断及治疗指南. 中华风湿病学杂志 14, 265-270 (2010).
14. 中华医学会风湿病学分会. 干燥综合征诊断及治疗指南. 中华风湿病学杂志 14, 766-768 (2010).
15. 中华医学会风湿病学分会. 系统性硬化病诊断及治疗指南. 中华风湿病学杂志 15, 256-259 (2011).
16. 中华医学会风湿病学分会. 抗磷脂综合征诊断和治疗指南. 中华风湿病学杂志 15, 407-410 (2011).
17. Sahin, U. et al. Human neoplasms elicit multiple specific immune responses in the autologous host. Proceedings of the National Academy of Sciences of the United States of America 92, 11810-11813 (1995).
18. Desmetz, C., Mange, A., Maudelonde, T. & Solassol, J. Autoantibody signatures: progress and perspectives for early cancer detection. Journal of cellular and molecular medicine 15, 2013-2024, doi:10.1111/j.1582-4934.2011.01355.x (2011).
19. Sahin, U. & Tureci, O. Antigen identification using SEREX. Methods in molecular biology 1061, 59-77, doi:10.1007/978-1-62703-589-7_3 (2013).
20. Jeoung, D. et al. Identification of autoantibody against poly (ADP-ribose) polymerase (PARP) fragment as a serological marker in systemic lupus erythematosus. Journal of autoimmunity 22, 87-94 (2004).
21. Uchida, K. et al. Identification of specific autoantigens in Sjogren's syndrome by SEREX. Immunology 116, 53-63, doi:10.1111/j.1365-2567.2005.02197.x (2005).
22. Maciejewska-Rodrigues, H. et al. Functional autoantibodies against serpin E2 in rheumatoid arthritis. Arthritis and rheumatism 62, 93-104, doi:10.1002/art.25038 (2010).
23. Ganesan, V., Ascherman, D. P. & Minden, J. S. Immunoproteomics technologies in the discovery of autoantigens in autoimmune diseases. Biomolecular concepts 7, 133-143, doi:10.1515/bmc-2016-0007 (2016).
24. Picotti, P. & Aebersold, R. Selected reaction monitoring-based proteomics: workflows, potential, pitfalls and future directions. Nature methods 9, 555-566, doi:10.1038/nmeth.2015 (2012).
25. Sanchez, T. W. et al. Immunoseroproteomic Profiling in African American Men with Prostate Cancer: Evidence for an Autoantibody Response to Glycolysis and Plasminogen-Associated Proteins. Molecular & cellular proteomics : MCP 15, 3564-3580, doi:10.1074/mcp.M116.060244 (2016).
26. Tan, H. T., Low, J., Lim, S. G. & Chung, M. C. Serum autoantibodies as biomarkers for early cancer detection. The FEBS journal 276, 6880-6904, doi:10.1111/j.1742-4658.2009.07396.x (2009).
27. Keshishian, H. et al. Quantitative, multiplexed workflow for deep analysis of human blood plasma and biomarker discovery by mass spectrometry. Nature protocols 12, 1683-1701, doi:10.1038/nprot.2017.054 (2017).
28. Wang, Q. et al. Selected reaction monitoring approach for validating peptide biomarkers. Proceedings of the National Academy of Sciences of the United States of America 114, 13519-13524, doi:10.1073/pnas.1712731114 (2017).
29. Hu, S. et al. A protein chip approach for high-throughput antigen identification and characterization. Proteomics 7, 2151-2161, doi:10.1002/pmic.200600923 (2007).
30. Jeong, J. S. et al. Rapid identification of monospecific monoclonal antibodies using a human proteome microarray. Molecular & cellular proteomics : MCP 11, O111 016253, doi:10.1074/mcp.O111.016253 (2012).
31. Zhu, H. et al. Global analysis of protein activities using proteome chips. Science (New York, N.Y.) 293, 2101-2105, doi:10.1126/science.1062191 (2001).
32. Hu, C. J. et al. Identification of new autoantigens for primary biliary cirrhosis using human proteome microarrays. Molecular & cellular proteomics : MCP 11, 669-680, doi:10.1074/mcp.M111.015529 (2012).
33. Hu, C. et al. Autoantibody profiling on human proteome microarray for biomarker discovery in cerebrospinal fluid and sera of neuropsychiatric lupus. PloS one 10, e0126643, doi:10.1371/journal.pone.0126643 (2015).
34. Hu, C. J. et al. Identification of Novel Biomarkers for Behcet Disease Diagnosis Using Human Proteome Microarray Approach. Molecular & cellular proteomics : MCP 16, 147-156, doi:10.1074/mcp.M116.061002 (2017).
35. Yang, L. et al. Identification of Serum Biomarkers for Gastric Cancer Diagnosis Using a Human Proteome Microarray. Molecular & cellular proteomics : MCP 15, 614-623, doi:10.1074/mcp.M115.051250 (2016).
第二阶段:使用定制小芯片进行大样本验证(Validation Phase)
通过蛋白质芯片筛选获得的初步候选的自身抗原库,连同文献报道的自身抗体,以及其它联合的自身免疫抗体,一并构建定制小芯片(Focused AAg Array),然后进行联合项目各个疾病的大样本检测(图 6),每 12 例样本对应 1 张芯片(12 个重复阵列小芯片),并获得所有响应数据。实施具体方案:
样本设置:
干燥综合症组:100 例;健康对照组:100 例。疾病和健康组样本要求同上;100 例样本也可包含初筛的各 15 例再检测(不建议)。
联合自免病对照组:100 例*(N-1)(如果 N 个风湿免疫病进行联合检测,那么第二阶段的数据将对其它联合的自免病自身抗体进行特异性识别,届时将产生 N 个联合疾病的标志物特异性数据;如果单独检测,则无联合自免病的对照组)。
数据分析:
随机选择 100 例(50 疾病/50 对照)样本进行模型训练(training),建立干燥综合症自身抗体组合的特异辨别模型;利用其余样本数据进行模型评估(test),直接评价其特异性和灵敏度;同时利用联合自免病产生的特异性数据,进行疾病间标志物特异性和灵敏性评价。最后利用模型获取的最佳数据进行 ROC 评价。
◇ Reference
1. Castiblanco, J., Arcos-Burgos, M. & Anaya, J. M. What is next after the genes for autoimmunity? BMC Med 11, 197, doi:10.1186/1741-7015-11-197 (2013).
2. Wahren-Herlenius, M. & Dorner, T. Immunopathogenic mechanisms of systemic autoimmune disease. Lancet (London, England) 382, 819-831, doi:10.1016/s0140-6736(13)60954-x (2013).
3. Theofilopoulos, A. N., Kono, D. H. & Baccala, R. The multiple pathways to autoimmunity. Nature immunology 18, 716-724, doi:10.1038/ni.3731 (2017).
4. Arbuckle, M. R. et al. Development of autoantibodies before the clinical onset of systemic lupus erythematosus. The New England journal of medicine 349, 1526-1533, doi:10.1056/NEJMoa021933 (2003).
5. Metcalf, J. V. et al. Natural history of early primary biliary cirrhosis. Lancet (London, England) 348, 1399-1402, doi:10.1016/s0140-6736(96)04410-8 (1996).
6. Majka, D. S. et al. Duration of preclinical rheumatoid arthritis-related autoantibody positivity increases in subjects with older age at time of disease diagnosis. Annals of the rheumatic diseases 67, 801-807, doi:10.1136/ard.2007.076679 (2008).
7. Sherer, Y., Gorstein, A., Fritzler, M. J. & Shoenfeld, Y. Autoantibody explosion in systemic lupus erythematosus: more than 100 different antibodies found in SLE patients. Seminars in arthritis and rheumatism 34, 501-537 (2004).
8. Hu, C. J., Zhang, F. C., Li, Y. Z. & Zhang, X. Primary biliary cirrhosis: what do autoantibodies tell us? World journal of gastroenterology 16, 3616-3629 (2010).
9. Shoenfeld, Y., Twig, G., Katz, U. & Sherer, Y. Autoantibody explosion in antiphospholipid syndrome. Journal of autoimmunity 30, 74-83, doi:10.1016/j.jaut.2007.11.011 (2008).
10. Leung, P. S. et al. Antimitochondrial antibodies in acute liver failure: implications for primary biliary cirrhosis. Hepatology 46, 1436-1442, doi:10.1002/hep.21828 (2007).
11. Bassyouni, I. H., Ezzat, Y., Hamdy, S. & Talaat, R. M. Clinical significance of anti-cyclic citrullinated peptide antibodies in Egyptian patients with chronic hepatitis C virus genotype IV infection. Clinical chemistry and laboratory medicine 47, 842-847, doi:10.1515/CCLM.2009.189 (2009).
12. 中华医学会风湿病学分会. 系统性红斑狼疮诊断及治疗指南中华医学会风湿病学分会. 中华风湿病学杂志 14 (2010).
13. 中华医学会风湿病学分会. 类风湿关节炎诊断及治疗指南. 中华风湿病学杂志 14, 265-270 (2010).
14. 中华医学会风湿病学分会. 干燥综合征诊断及治疗指南. 中华风湿病学杂志 14, 766-768 (2010).
15. 中华医学会风湿病学分会. 系统性硬化病诊断及治疗指南. 中华风湿病学杂志 15, 256-259 (2011).
16. 中华医学会风湿病学分会. 抗磷脂综合征诊断和治疗指南. 中华风湿病学杂志 15, 407-410 (2011).
17. Sahin, U. et al. Human neoplasms elicit multiple specific immune responses in the autologous host. Proceedings of the National Academy of Sciences of the United States of America 92, 11810-11813 (1995).
18. Desmetz, C., Mange, A., Maudelonde, T. & Solassol, J. Autoantibody signatures: progress and perspectives for early cancer detection. Journal of cellular and molecular medicine 15, 2013-2024, doi:10.1111/j.1582-4934.2011.01355.x (2011).
19. Sahin, U. & Tureci, O. Antigen identification using SEREX. Methods in molecular biology 1061, 59-77, doi:10.1007/978-1-62703-589-7_3 (2013).
20. Jeoung, D. et al. Identification of autoantibody against poly (ADP-ribose) polymerase (PARP) fragment as a serological marker in systemic lupus erythematosus. Journal of autoimmunity 22, 87-94 (2004).
21. Uchida, K. et al. Identification of specific autoantigens in Sjogren's syndrome by SEREX. Immunology 116, 53-63, doi:10.1111/j.1365-2567.2005.02197.x (2005).
22. Maciejewska-Rodrigues, H. et al. Functional autoantibodies against serpin E2 in rheumatoid arthritis. Arthritis and rheumatism 62, 93-104, doi:10.1002/art.25038 (2010).
23. Ganesan, V., Ascherman, D. P. & Minden, J. S. Immunoproteomics technologies in the discovery of autoantigens in autoimmune diseases. Biomolecular concepts 7, 133-143, doi:10.1515/bmc-2016-0007 (2016).
24. Picotti, P. & Aebersold, R. Selected reaction monitoring-based proteomics: workflows, potential, pitfalls and future directions. Nature methods 9, 555-566, doi:10.1038/nmeth.2015 (2012).
25. Sanchez, T. W. et al. Immunoseroproteomic Profiling in African American Men with Prostate Cancer: Evidence for an Autoantibody Response to Glycolysis and Plasminogen-Associated Proteins. Molecular & cellular proteomics : MCP 15, 3564-3580, doi:10.1074/mcp.M116.060244 (2016).
26. Tan, H. T., Low, J., Lim, S. G. & Chung, M. C. Serum autoantibodies as biomarkers for early cancer detection. The FEBS journal 276, 6880-6904, doi:10.1111/j.1742-4658.2009.07396.x (2009).
27. Keshishian, H. et al. Quantitative, multiplexed workflow for deep analysis of human blood plasma and biomarker discovery by mass spectrometry. Nature protocols 12, 1683-1701, doi:10.1038/nprot.2017.054 (2017).
28. Wang, Q. et al. Selected reaction monitoring approach for validating peptide biomarkers. Proceedings of the National Academy of Sciences of the United States of America 114, 13519-13524, doi:10.1073/pnas.1712731114 (2017).
29. Hu, S. et al. A protein chip approach for high-throughput antigen identification and characterization. Proteomics 7, 2151-2161, doi:10.1002/pmic.200600923 (2007).
30. Jeong, J. S. et al. Rapid identification of monospecific monoclonal antibodies using a human proteome microarray. Molecular & cellular proteomics : MCP 11, O111 016253, doi:10.1074/mcp.O111.016253 (2012).
31. Zhu, H. et al. Global analysis of protein activities using proteome chips. Science (New York, N.Y.) 293, 2101-2105, doi:10.1126/science.1062191 (2001).
32. Hu, C. J. et al. Identification of new autoantigens for primary biliary cirrhosis using human proteome microarrays. Molecular & cellular proteomics : MCP 11, 669-680, doi:10.1074/mcp.M111.015529 (2012).
33. Hu, C. et al. Autoantibody profiling on human proteome microarray for biomarker discovery in cerebrospinal fluid and sera of neuropsychiatric lupus. PloS one 10, e0126643, doi:10.1371/journal.pone.0126643 (2015).
34. Hu, C. J. et al. Identification of Novel Biomarkers for Behcet Disease Diagnosis Using Human Proteome Microarray Approach. Molecular & cellular proteomics : MCP 16, 147-156, doi:10.1074/mcp.M116.061002 (2017).
35. Yang, L. et al. Identification of Serum Biomarkers for Gastric Cancer Diagnosis Using a Human Proteome Microarray. Molecular & cellular proteomics : MCP 15, 614-623, doi:10.1074/mcp.M115.051250 (2016).












