产品分类
公司荣誉
公司图片
联系方式
公司新闻
肿瘤早期诊断自身抗体标志物筛选
发布时间:2019-02-19 14:35 | 点击次数:
TEAMS (Tumor Early-diagnosis Autoantibody bioMarker Screening)
一、 项目概述
TEAMS(Tumor Early-diagnosis Autoantibody bioMarker Screening)计划,以恶性肿瘤早期诊断为项目切入点,基于HuProt™ 人类全蛋白质组芯片以及博翀生物公司蛋白质芯片技术平台,同国内相关领域的临床专家、医院进行合作,以系统性的筛选、发现、建立和验证一系列的肿瘤早期诊断的自身抗体或组合,并通过大量的不同肿瘤、不同疾病的比对,建立基于大样本量的、具有统计学意义的临床应用评价,尝试建立一批早期诊断试剂盒雏形。
二、背景
恶性肿瘤是威胁人类生命的重大疾病之一。虽然经过数代科学家和临床医生的努力,肿瘤的治疗有了很大的进展,但高死亡率仍未得到有效控制1。早期诊断,即在未出现显著的临床症状或可治愈阶段实现肿瘤的诊断,对于降低死亡率效果显著1。基于血清标志物的早期检测方法因无创、操作方便、适用于广泛筛查等优势被寄予厚望2。目前,从血清中发现的具有肿瘤早期诊断价值的分子或细胞包括诸多类型,如糖蛋白,自身抗体,microRNA,循环肿瘤细胞(CTC),循环肿瘤DNA(ctDNA),外泌体等2。其中,自身抗体,即机体针对肿瘤异常抗原发生免疫响应而产生的特异性抗体,逐渐被认识到具备巨大的早期诊断潜力1,3,4。
早在 20 世纪 60 年代,Robert W. Baldwin5 发现机体可针对肿瘤产生免疫反应。后经大量研究得到验证,肿瘤发生过程中,异常表达的蛋白可刺激机体免疫系统、产生抗体,这些蛋白被称为肿瘤相关抗原(Tumor Associated-Antigen, TAA),对应的抗体称为自身抗体 ( Autoantibody, AAb)6。自身抗体产生的机制目前尚不完全明确,主流的理论假说是免疫监视(Immune Surveillance)理论3,6–9(Figure 1),肿瘤发生过程中受到免疫系统的攻击,同时诱导 T 细胞主导的细胞免疫和 B 细胞主导的体液免疫;为了对抗这种攻击,肿瘤细胞利用一系列的抑制产生免疫逃逸,比如诱发免疫检查点蛋白 PD-L1 通路,抑制 T 细胞活性,因此免疫治疗通过抑制这种对抗或重新激活 T 细胞表现出肿瘤治疗的潜力10。另一方面,B 细胞针对肿瘤抗原产生抗体,即自身抗体则被释放到血液中7,11,最近的一些研究表面,B 细胞及肿瘤抗原的抗体对于肿瘤的免疫治疗或许有很大的帮助12,13。综合文献报道,能够引起机体产生免疫反应的抗原包括蛋白的异常高表达、突变、错误折叠、错误定位以及修饰异常等14,15,而蛋白的来源包括核蛋白、细胞质蛋白等,蛋白的功能涉及肿瘤抑癌基因、细胞周期蛋白、RNA 结合蛋白、生长因子等2,16。其中,p53 抗体是最具代表性、研究最为广泛的肿瘤相关自身抗体。p53 是抑癌基因 TP53 的产物,参与细胞周期调控,引导 DNA 修复和细胞凋亡。超过 50% 的癌症病人中发现 p53 基因突变(主要发生了 DNA 结合结构域),突变后的蛋白失去调控功能,细胞癌变容易发生。另外,突变的 p53 稳定性增加(半衰期延长)导致在细胞核中累积17,从而刺激免疫反应导致自身抗体的出现。p53 抗体最早由 Crawford 等人于 1982 年发现18,广泛出现在各种类型的肿瘤病人的血液中,在健康人中很少检测到,因此其特异性较高(96%),但跟很多自身抗体特异形似,p53 抗体仅在~30% 的肿瘤病人中被检测到,因此灵敏度偏低。然而,研究发现,p53 抗体可先于临床症状几个月至几年即可出现,因此可用于高危人群的筛查17,并且和治疗有密切的相关性,可作为复发检测指标19,20。
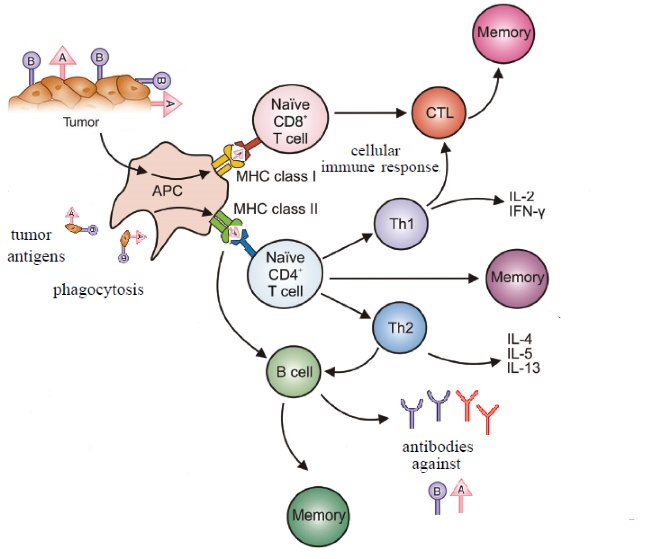
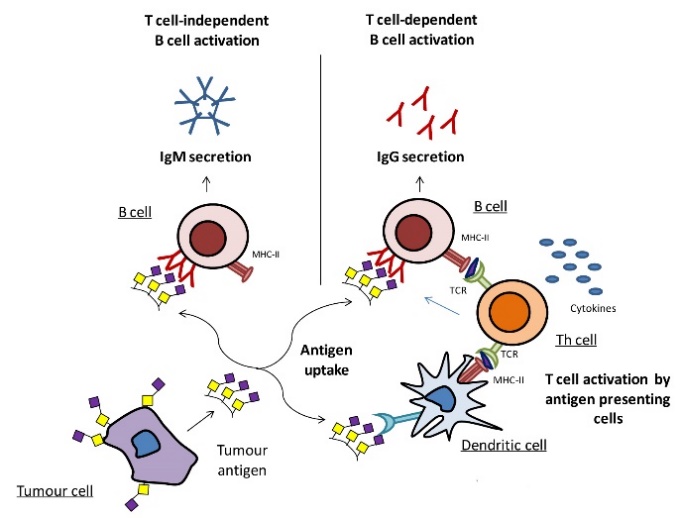
Figure 1 肿瘤自身抗体产生的机制(假说) A) 肿瘤诱导免疫反应的过程和分子事件7;B) 基于免疫监视理论,描述的自身抗体产生的大致过程11。
自身抗体用于肿瘤早期诊断的价值已获得广泛认可,而且在多种类型肿瘤中已经发现多个 TAAs,如肺癌21,22,肝癌23,24,胃癌25,26,胰腺癌27,28,前列腺癌4,29 等。作为早期诊断的一种工具,自身抗体具有以下几个优点:
1) 伴随肿瘤的发生过程产生,先于临床症状,适用于早期诊断。
肿瘤的发生是一个不易察觉的过程,而目前的诊断手段往往基于影像学且需要已具备明显的临床症状。然而,自身抗体可先于临床症状几个月到几年的时间出现明显的升高。Zhang 等30 基于回顾性研究,发现在肝癌病人诊断的时间之前,已经发现该病人血清中抗核抗体的显著升高,针对自身抗原 p62 的抗体水平也是如此(Figure 2A)。Liu 等人31 同样在肝癌病人血清中发现抗原 MDMD2 的自身抗体,并基于一系列不同时间点的样本检测,发现病人诊断之前的 6~9 个月该自身抗体水平有一个显著提高的过程(Figure 2C)。同样的,研究人员在肺癌中也发现了类似的现象(Figure 2B)21。
自身抗体用于肿瘤早期诊断的价值已获得广泛认可,而且在多种类型肿瘤中已经发现多个 TAAs,如肺癌21,22,肝癌23,24,胃癌25,26,胰腺癌27,28,前列腺癌4,29 等。作为早期诊断的一种工具,自身抗体具有以下几个优点:
1) 伴随肿瘤的发生过程产生,先于临床症状,适用于早期诊断。
肿瘤的发生是一个不易察觉的过程,而目前的诊断手段往往基于影像学且需要已具备明显的临床症状。然而,自身抗体可先于临床症状几个月到几年的时间出现明显的升高。Zhang 等30 基于回顾性研究,发现在肝癌病人诊断的时间之前,已经发现该病人血清中抗核抗体的显著升高,针对自身抗原 p62 的抗体水平也是如此(Figure 2A)。Liu 等人31 同样在肝癌病人血清中发现抗原 MDMD2 的自身抗体,并基于一系列不同时间点的样本检测,发现病人诊断之前的 6~9 个月该自身抗体水平有一个显著提高的过程(Figure 2C)。同样的,研究人员在肺癌中也发现了类似的现象(Figure 2B)21。
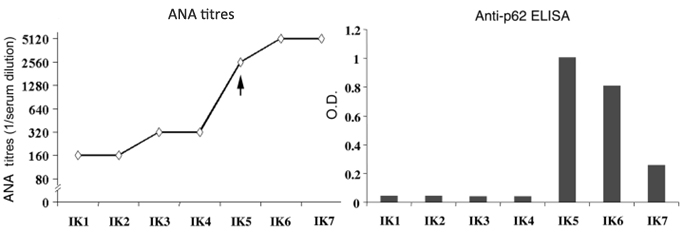

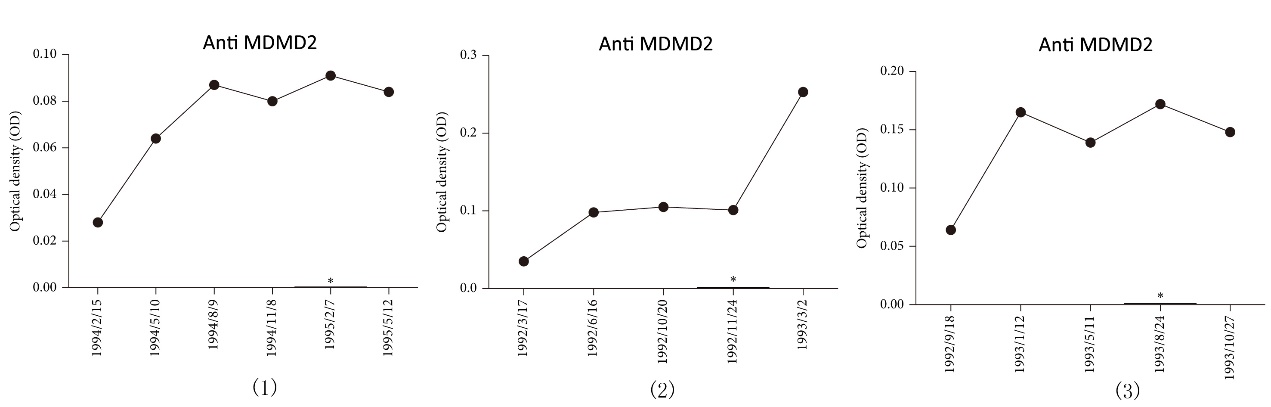
Figure 2 肿瘤自身抗体往往出现在肿瘤发生时,可早于临床症状几个月到几年被检测,因此具有早期诊断的价值。 A) 同一肝癌病人不同样本采集点的血清中抗核抗体(ANA)以及 p62 抗体的变化。箭头表示诊断为肝癌的时间点30。B) 14 个肺癌病人,诊断前不同样本采集点的血清中 RalA 抗体的变化。多个病人在临床确诊前 1~5 年表现出不同程度的抗体浓度升高21。C) 3 个肝癌病人,不同样本采集点的血清中 MDMD2 抗体的变化。星号标记的位置为肝癌诊断时间点31。
2) 自身抗体的产生是免疫反应的结果,经过免疫系统的放大,抗体比起蛋白更容易检测24,32;
3) 具有特定类型肿瘤特异性。研究发现存在一些抗原是肿瘤特有的,但不同肿瘤间无特异性,如 p53; 也有一些抗原是特定肿瘤特异性的,比如前列腺癌的很多 TAAs 是与氧化应激相关的蛋白14。
但对于特定的一个 TAA,其自身抗体仅出现在 10~30% 的病人中16,33,17,因此作为诊断工具,其灵敏度偏低。这可能源于肿瘤的异质性或者免疫反应的多样性。因此,建立一个标志物组合,将多个 TAA 联合使用是一种有效的策略,在维持较高特异性的前提下,提高检测灵敏度,从而应用于临床诊断。例如,Zhang 等34 建立一个含有 8 个自身抗原标志物的组合(IMP1, IMP2, IMP3, c-myc, p53, survivin, cyclin B1, p16),可以提高检测灵敏度至 60%,特异性为 82.4%。
2) 自身抗体的产生是免疫反应的结果,经过免疫系统的放大,抗体比起蛋白更容易检测24,32;
3) 具有特定类型肿瘤特异性。研究发现存在一些抗原是肿瘤特有的,但不同肿瘤间无特异性,如 p53; 也有一些抗原是特定肿瘤特异性的,比如前列腺癌的很多 TAAs 是与氧化应激相关的蛋白14。
但对于特定的一个 TAA,其自身抗体仅出现在 10~30% 的病人中16,33,17,因此作为诊断工具,其灵敏度偏低。这可能源于肿瘤的异质性或者免疫反应的多样性。因此,建立一个标志物组合,将多个 TAA 联合使用是一种有效的策略,在维持较高特异性的前提下,提高检测灵敏度,从而应用于临床诊断。例如,Zhang 等34 建立一个含有 8 个自身抗原标志物的组合(IMP1, IMP2, IMP3, c-myc, p53, survivin, cyclin B1, p16),可以提高检测灵敏度至 60%,特异性为 82.4%。
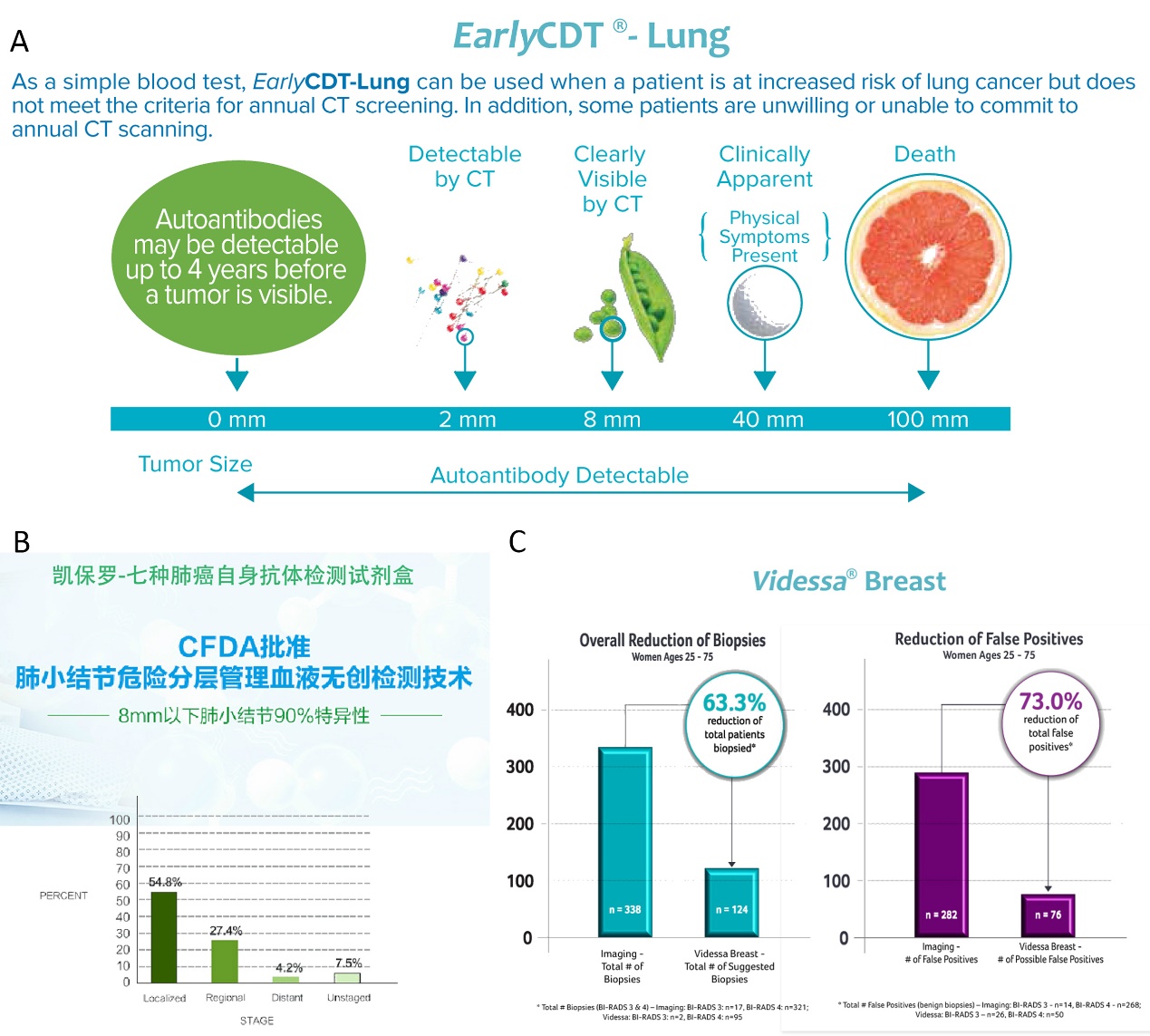
Figure 3 自身抗体用于癌症早期检测的商业化试剂盒。A) 英国 Oncimmune 公司推出的肺癌检测试剂盒 EarlyCDT® Lung,可联合低剂量 CT 辅助肺癌早期诊断,特别是肿瘤无法检测的早期(资料来源:www.oncimmune.com)。B) 中国凯保罗研制的七种自身抗体检测试剂盒,用于肺癌早期诊断,有助于提高 8 mm 以下肺小结节的检测特异性(资料来源:www.cancerprobe.cn)。C) 美国 Provisa 公司开发的 Videssa® Breast 乳腺癌早期诊断试剂盒,可极大降低乳房 X 射线技术带来的假阳性评价(资料来源:www.provistadx.com)。
令人鼓舞的是,市场上已经出现了商业化试剂盒。1) 英国 Oncimmune 公司推出的肺癌检测试剂盒 EarlyCDT® Lung(Figure 3A),基于 7 种自身抗原的检测(CAGE, HuD, NY-ESO-1, SOX-2, GBU4-5, MAGE A4, p53),检测灵敏度 41%,特异性 91%,准确度 92%,尤其是能够与目前主流的肺癌筛查方法低剂量 CT 形成互补,降低其假阳性率35,36。研究发现该产品在早期诊断中具有优势(20% 早期可检测,可提前临床症状 5 年)。基于此产品,英国国家健康中心(National Health Service, NHS)主导启动了ECLS(The National Health Service Scotland Early Lung Cancer Detection Study)项目,已招募 12,000 高危人群,系统性地验证 EarlyCDT-Lung 的筛查和诊断价值,2016 年 12 月公布的初步结果显示,具有比预期高的灵敏度和很好的早期诊断价值37,整个项目完成时间在 2019 年。2) 中国凯保罗公司开发的肺癌检测试剂盒(Figure 3B)。在国家卫计委肺癌专家组成员、上海市肺科医院肿瘤科主任周彩存教授组织的临床研究团队的带领下,经过中国六家临床多中心进行了大样本临床研究,杭州凯保罗生物科技有限公司自主研发的 7 种自身抗体(p53, GAGE 7, PGP9.5, CAGE, MAGE A1, SOX2, GBU4-5)肺癌检测试剂盒,是首.个被国家食品药品监督管理局(CFDA)批准的用于联合低剂量螺旋 CT 的肺癌检测试剂盒,在肺癌早期检测领域有重要的意义(国械注准20153402087)。3) 美国 Provisa 公司(实验室获得 CLIA 和 CAP 认证)开发的 Videssa® Breast 乳腺癌早期诊断试剂盒,包含 23 个蛋白和自身抗体检测指标,阴性预测率高达 98~99.3%,可将乳房 X 射线的影像学检测的假阳性利率降低 73%,从而降低乳腺癌的过度治疗38。
综上所述,我们认为自身抗体用于肿瘤早期诊断是一个值得探索的方向,并极有可能率先或联合其它方式共同应用于肿瘤的广泛筛查和早期诊断。
三、项目目标和意义
3.1 项目目标
令人鼓舞的是,市场上已经出现了商业化试剂盒。1) 英国 Oncimmune 公司推出的肺癌检测试剂盒 EarlyCDT® Lung(Figure 3A),基于 7 种自身抗原的检测(CAGE, HuD, NY-ESO-1, SOX-2, GBU4-5, MAGE A4, p53),检测灵敏度 41%,特异性 91%,准确度 92%,尤其是能够与目前主流的肺癌筛查方法低剂量 CT 形成互补,降低其假阳性率35,36。研究发现该产品在早期诊断中具有优势(20% 早期可检测,可提前临床症状 5 年)。基于此产品,英国国家健康中心(National Health Service, NHS)主导启动了ECLS(The National Health Service Scotland Early Lung Cancer Detection Study)项目,已招募 12,000 高危人群,系统性地验证 EarlyCDT-Lung 的筛查和诊断价值,2016 年 12 月公布的初步结果显示,具有比预期高的灵敏度和很好的早期诊断价值37,整个项目完成时间在 2019 年。2) 中国凯保罗公司开发的肺癌检测试剂盒(Figure 3B)。在国家卫计委肺癌专家组成员、上海市肺科医院肿瘤科主任周彩存教授组织的临床研究团队的带领下,经过中国六家临床多中心进行了大样本临床研究,杭州凯保罗生物科技有限公司自主研发的 7 种自身抗体(p53, GAGE 7, PGP9.5, CAGE, MAGE A1, SOX2, GBU4-5)肺癌检测试剂盒,是首.个被国家食品药品监督管理局(CFDA)批准的用于联合低剂量螺旋 CT 的肺癌检测试剂盒,在肺癌早期检测领域有重要的意义(国械注准20153402087)。3) 美国 Provisa 公司(实验室获得 CLIA 和 CAP 认证)开发的 Videssa® Breast 乳腺癌早期诊断试剂盒,包含 23 个蛋白和自身抗体检测指标,阴性预测率高达 98~99.3%,可将乳房 X 射线的影像学检测的假阳性利率降低 73%,从而降低乳腺癌的过度治疗38。
综上所述,我们认为自身抗体用于肿瘤早期诊断是一个值得探索的方向,并极有可能率先或联合其它方式共同应用于肿瘤的广泛筛查和早期诊断。
三、项目目标和意义
3.1 项目目标
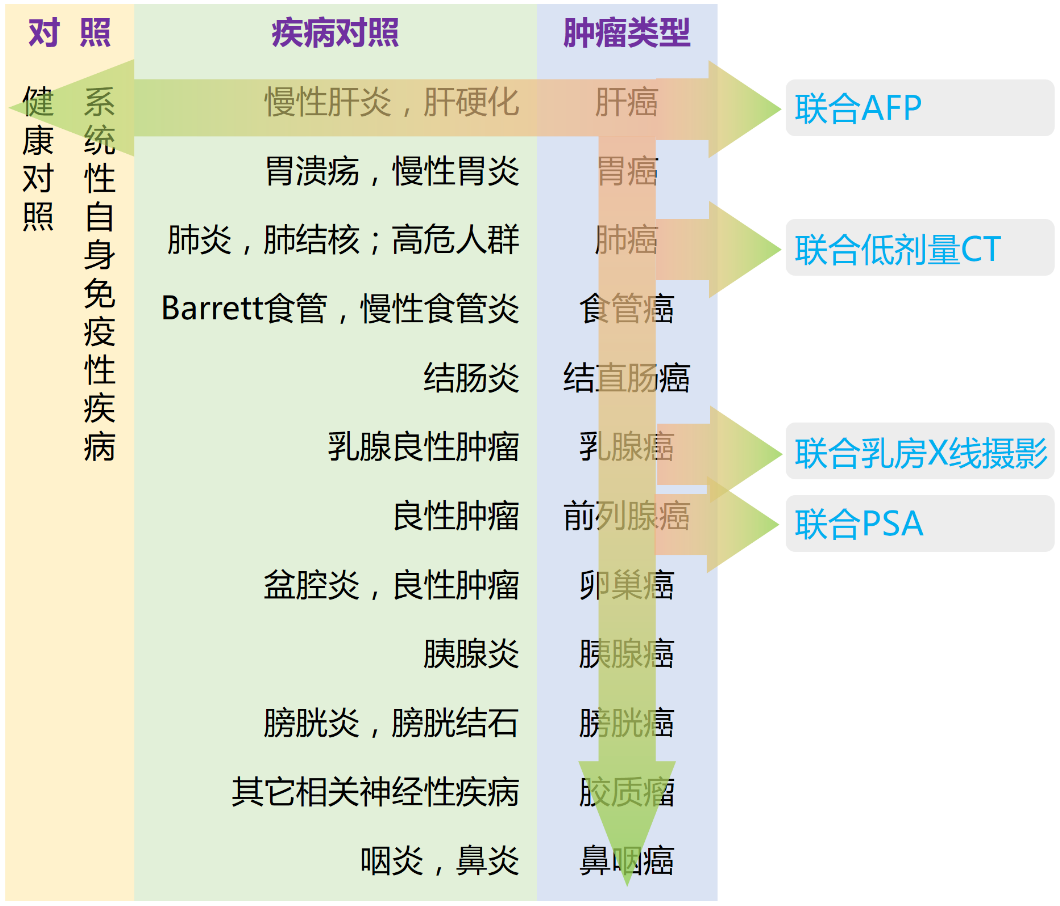
Figure 4.TEAMS计划实施策略。以肝癌为例,在验证阶段采用2个维度的数据比对,以获得肝癌特异性的诊断标志物组合:横向,相关疾病对照、健康对照以及系统性自免疾病;纵向,其它肿瘤类型(通过共享的方式获得)。同时,以目前主要的诊断方式联合为切入点,以获得最优诊断效果。
本项目旨在系统性地、广泛地筛选肺癌、胃癌、肝癌、食管癌、肝癌、结直肠癌、乳腺癌、前列腺癌、卵巢癌、胰腺癌和鼻咽癌等恶性肿瘤的特异性自身抗体标志物,通过大量数据的比对(横向:各器官炎症、良性肿瘤以及健康对照和自身免疫性疾病对照;纵向:不同肿瘤),为每一种肿瘤,建立一个特异性的肿瘤自身抗体组合,并进行大样本的、可靠的评价,以实现肿瘤的早期诊断(Figure 4)。
本项目旨在系统性地、广泛地筛选肺癌、胃癌、肝癌、食管癌、肝癌、结直肠癌、乳腺癌、前列腺癌、卵巢癌、胰腺癌和鼻咽癌等恶性肿瘤的特异性自身抗体标志物,通过大量数据的比对(横向:各器官炎症、良性肿瘤以及健康对照和自身免疫性疾病对照;纵向:不同肿瘤),为每一种肿瘤,建立一个特异性的肿瘤自身抗体组合,并进行大样本的、可靠的评价,以实现肿瘤的早期诊断(Figure 4)。
- 切入点:建立全新的标志物组合,或联合目前的方法或标志物建立组合;
- 方法:基于 HuProt™ 人类全蛋白质组芯片(~20,000 个人重组蛋白)+文献报道的 TAA,利用蛋白质芯片平台大规模验证;
- 技术平台:博翀公司蛋白质芯片平台:标准化,规模化;
- 流程:初筛 — 大规模样本训练 — 独立样本验证;
- 目标:自身抗体标志物组合,ROC 曲线(经独立验证的)评价。量化指标:1. 发表高质量的学术文章至少 1 篇(JCO 水平):高质量的学术文章要求严谨的实验设计、严格的样本控制、结论明确且足够的数据支撑(样本量够大,具代表性,独立样本的双盲验证)、结果具有临床应用潜力。另外,后续可进行一系列地研究,发表一系列的文章。2. 申请 4~8 项发明专利,对发现的具有早期诊断价值的标志物或标志物组合实施专利保护,并开始进行商业转化。
3.2 意义
自身抗体具有潜在的肿瘤早期诊断的价值。虽然目前研究的文章很多,并逐年呈上涨趋势,但至今应用到临床的极少。究其原因无外乎为实验设计缺少合理性,缺少大样本验证,标准不一致以致实验重复性较差等16。到目前为止,从未有报道以工业化、规模化的方式,对肿瘤血清自身抗体标志物进行系统性研究,并以临床诊断为切入点进行发现、比较和评价。TEAMS 计划,首次以系统化的方式,基于全球最高通量的全人类蛋白质组芯片(抗原芯片), 依赖于博翀生物公司规模化、标准化的高通量实验平台,发现并评价各肿瘤的自身抗体标志物,对于肿瘤早期诊断具有现实意义,同时,经过大样本量、统计学和多个维度的比对分析,能够对自身抗体作为肿瘤标志物的意义做出有效评价。
HuProt™ 人类全蛋白质组芯片是最早由美国 Johns Hopkins 大学高通量中心的朱衡教授开发,是目前为止最高通量的蛋白质组芯片,涵盖人类重组蛋白 ~20,000 个 39~41( Figure 5)。蛋白质大部分是基因全长序列,部分是不同剪切体形式,通过高通量重组蛋白质制备方式获得,表达宿主是酵母,纯化方式为 GST 标签亲和纯化41。该款蛋白质芯片已应用于自身免疫性肝炎42、系统性红斑狼疮43、白塞病44 等自身免疫性疾病,以及胃癌25、黑色素瘤45 等恶性肿瘤的生物标志物发现。
该芯片自 2014 年开始商业化,经美国 CDI Laboratory 公司升级、改造,从蛋白浓度、基片、点样方式等进行了一系列优化并实现了批量生产。而此时我们正面临这样一个机会,一方面,世界范围内,该产品至今未进行大规模的使用,尤其是在肿瘤标志物筛选这个领域;标志物筛选具有一定的排他性,若是已有类似报道,研究的创新性就可能受到挑战。另一方面,我国的临床医学正经历快速发展通道,临床研究水平接近世界先进水平,临床样本质量有了极大提高,临床样本数量庞大且相对容易获得,在血清标志物筛选方面具备有力条件,应率先探索其可行性,有可能成为引领世界的一个方向。
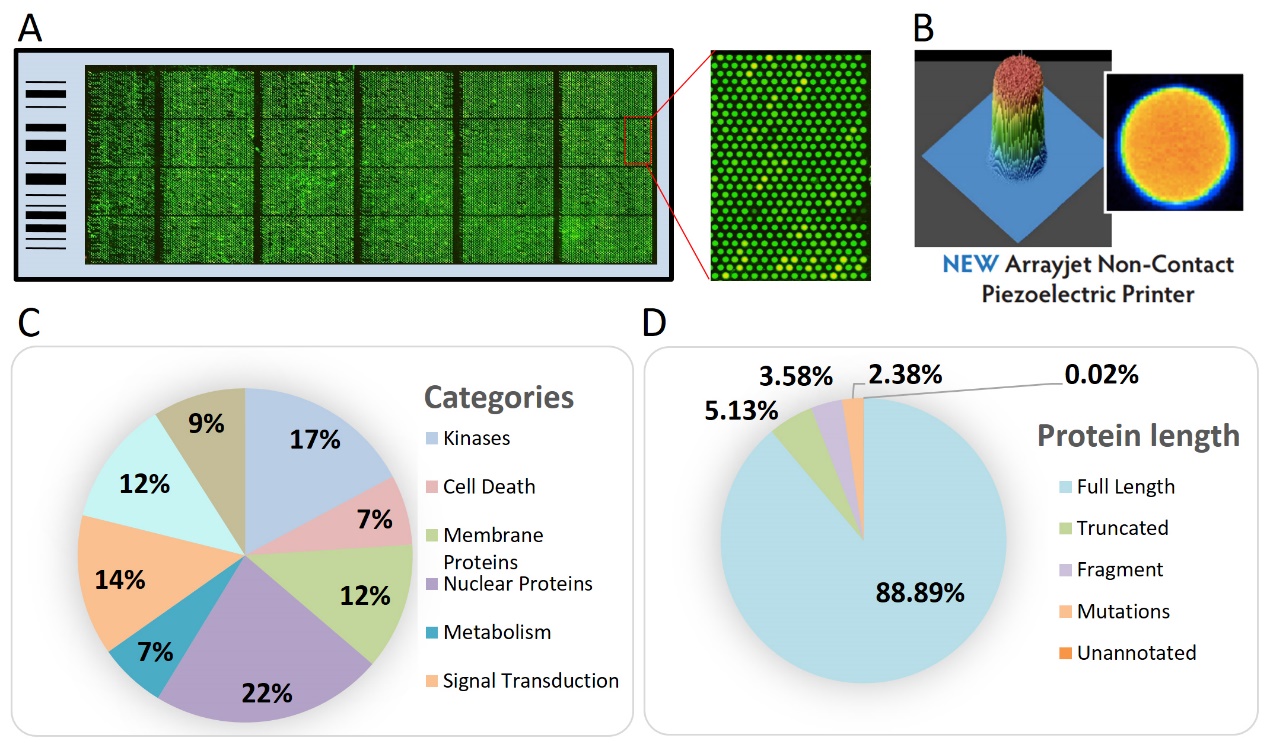
Figure 5 HuProt™ 人类全蛋白质组芯片。A) 芯片质控图片,使用 anti-GST 孵育检测;芯片共有 24 个阵列,包含人类重复蛋白 19,394 个,每个蛋白重复 2 点。B) 点样质量说明。芯片制备采用先进的非接触式点样系统,使点样更均匀。C) 蛋白质按照种类归类分析。D) 蛋白质按照长度归类分析,其中大部分蛋白质为全长表达(88.9%)。
更进一步,免疫涉及各类疾病,仅就肿瘤而言,免疫治疗就是一个非常有前景的研究方向。免疫蛋白质组学,即从抗原的角度解析庞大的免疫系统,越来越引起科学家的关注,随着大数据分析和挖掘能力的提高,该领域有望产生重大意义的研究成果。TEAMS计划所产生的数据同时可作为华人免疫蛋白质组库的一部分,以贡献于我国在该领域的研究空白。
四、肿瘤自身抗体标志物研究现状
自身抗体的发现均是由其识别的抗原进行定义的,筛选、发现自身抗体(或抗原)的方法均基于免疫检测,本质上是抗原库的制备和免疫筛选的建立(Figure 6)。抗原的来源包括重组表达蛋白、cDNA 表达库、细胞或组织分离的蛋白质组;筛选方法主要是免疫印迹和高通量蛋白质芯片;后续基于测序或质谱的方式鉴定 TAA。
更进一步,免疫涉及各类疾病,仅就肿瘤而言,免疫治疗就是一个非常有前景的研究方向。免疫蛋白质组学,即从抗原的角度解析庞大的免疫系统,越来越引起科学家的关注,随着大数据分析和挖掘能力的提高,该领域有望产生重大意义的研究成果。TEAMS计划所产生的数据同时可作为华人免疫蛋白质组库的一部分,以贡献于我国在该领域的研究空白。
四、肿瘤自身抗体标志物研究现状
自身抗体的发现均是由其识别的抗原进行定义的,筛选、发现自身抗体(或抗原)的方法均基于免疫检测,本质上是抗原库的制备和免疫筛选的建立(Figure 6)。抗原的来源包括重组表达蛋白、cDNA 表达库、细胞或组织分离的蛋白质组;筛选方法主要是免疫印迹和高通量蛋白质芯片;后续基于测序或质谱的方式鉴定 TAA。
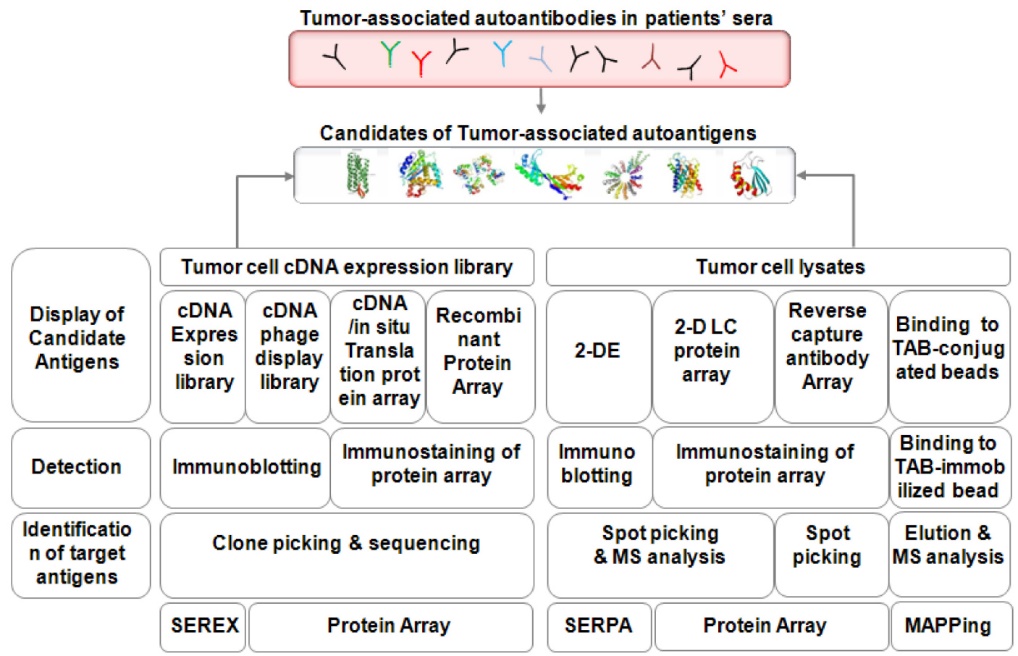
Figure 6 自身抗体发现的方法汇总46。按照抗原来源(展示)、检测方法以及抗原鉴定的流程进行分类。
主要的方法包括以下几种:
1) SEREX (SERological analysis of tumor antigens by recombinant
cDNA EXpression cloning)方法由 Sahin 等人于 1995 年建立47,基于病人的肿瘤组织获得总 RNA,通过逆转录得到 cDNA 文库,并建立噬菌体克隆库和转染到大肠杆菌中。通过固体培养和诱导表达重组蛋白并转移到膜上,并使用该病人的血清进行免疫检测,阳性克隆通过测序获得抗原信息(Figure 7)16。目前,应用SEREX技术,已鉴定出多种 TAA16,48。但是该方法在建库的过程中往往导致蛋白表达的不均衡,更偏向于组织中高丰度的抗原,导致一些低丰度蛋白难以检测。另外,整个实验过程步骤繁多,抗原库来源和血清的数量都收到很大的限制,因此不适用大量样本的筛选,无法消除个体差异以及自身抗体多样性带来的偶然性。
类似的技术还有噬菌体库淘选(Phage library panning)4,49,不直接进行转膜和血清筛选,而是采用多个血清和多轮淘选的方式进行,一般可先进行健康对照样本的去除,再进行病人血清样本的富集,获得的阳性克隆同样采用基因测序的方式获得。
主要的方法包括以下几种:
1) SEREX (SERological analysis of tumor antigens by recombinant
cDNA EXpression cloning)方法由 Sahin 等人于 1995 年建立47,基于病人的肿瘤组织获得总 RNA,通过逆转录得到 cDNA 文库,并建立噬菌体克隆库和转染到大肠杆菌中。通过固体培养和诱导表达重组蛋白并转移到膜上,并使用该病人的血清进行免疫检测,阳性克隆通过测序获得抗原信息(Figure 7)16。目前,应用SEREX技术,已鉴定出多种 TAA16,48。但是该方法在建库的过程中往往导致蛋白表达的不均衡,更偏向于组织中高丰度的抗原,导致一些低丰度蛋白难以检测。另外,整个实验过程步骤繁多,抗原库来源和血清的数量都收到很大的限制,因此不适用大量样本的筛选,无法消除个体差异以及自身抗体多样性带来的偶然性。
类似的技术还有噬菌体库淘选(Phage library panning)4,49,不直接进行转膜和血清筛选,而是采用多个血清和多轮淘选的方式进行,一般可先进行健康对照样本的去除,再进行病人血清样本的富集,获得的阳性克隆同样采用基因测序的方式获得。
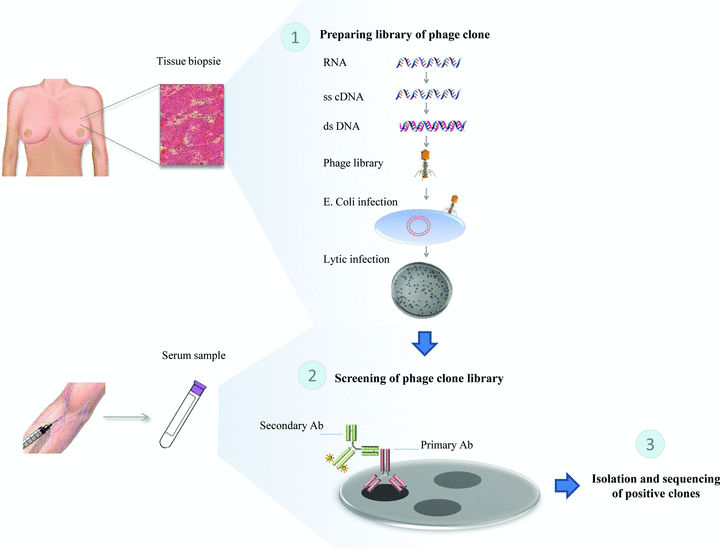
Figure 7 SEREX方法示意图16。1) 基于肿瘤组织或细胞系裂解液制备噬菌体蛋白库;2) 血清学筛选;3) 挑选阳性克隆通过测序鉴定抗原。
2) SERPA(SERological Proteome Analysis)直接基于组织或细胞裂解
液,通过二维电泳进行分离,并进行血清的免疫印迹,阳性或差异的蛋白通过质谱得以鉴定29,48(Figure 8)16。该方法的优势是基于天然样本而非重组蛋白,因此能最大程度上保持蛋白的翻译后修饰(PTMs)和剪切体形式。但是同样存在蛋白丰度不均匀的问题,对于低丰度蛋白无法有效检测,另外,实验过程严重依赖于人员操作,获得可重复性的二位电泳和免疫印迹是件非常困难的事情。
2) SERPA(SERological Proteome Analysis)直接基于组织或细胞裂解
液,通过二维电泳进行分离,并进行血清的免疫印迹,阳性或差异的蛋白通过质谱得以鉴定29,48(Figure 8)16。该方法的优势是基于天然样本而非重组蛋白,因此能最大程度上保持蛋白的翻译后修饰(PTMs)和剪切体形式。但是同样存在蛋白丰度不均匀的问题,对于低丰度蛋白无法有效检测,另外,实验过程严重依赖于人员操作,获得可重复性的二位电泳和免疫印迹是件非常困难的事情。
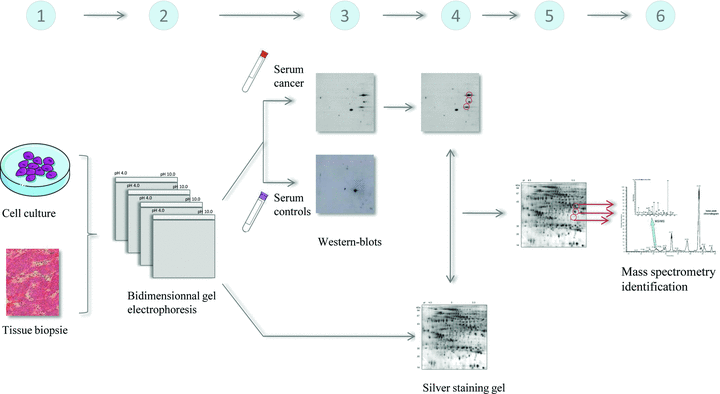
Figure 8 SERPA方法示意图16。1) 抗原库来源为细胞系或肿瘤组织裂解液;2) 2 维电泳分离样本;3) 血清 Western Blot(正常和对照);4) 发现差异蛋白所在位置;5) 对比银染的 PAGE 胶找出差异蛋白;6) 质谱鉴定。
3) MAPPing(Multiple Affinity Protein Profiling)基于肿瘤组织和细
胞系裂解液,首先用磁珠固定的健康对照的血清去除与之结合的蛋白,再使用来自肿瘤病人的血清捕获剩余的蛋白,然后通过质谱得以鉴定48。这种方法类似于 Phage Library Panning,不同的是抗原库源于天然样本,而无法多次淘选和富集,导致存在一定的假阳性和假阴性。
4) Protein microarray,蛋白质芯片技术,根据抗原库来源不同分为两种
形式(Figure 9)16,一是反向蛋白质芯片(reverse protein microarray),即将特定抗体固定于芯片表面,首先捕获肿瘤组织或细胞系裂解液中的蛋白,再基于血清学高通量检测获得差异性或阳性蛋白,通过抗体的特异性确定抗原信息。它的优势在于,可以分析天然抗原和天然构象表位,但这种方法依赖于抗体的个数和质量,很难获得足够的抗原库。另外一种是是重组蛋白质芯片,即将确定的重组蛋白直接固定于芯片表面,进而进行血清学筛选,这是最直接的一种方式,同时满足高通量和大量样本筛选的需求。但是获得足够多种类的重组蛋白是一个瓶颈48。
3) MAPPing(Multiple Affinity Protein Profiling)基于肿瘤组织和细
胞系裂解液,首先用磁珠固定的健康对照的血清去除与之结合的蛋白,再使用来自肿瘤病人的血清捕获剩余的蛋白,然后通过质谱得以鉴定48。这种方法类似于 Phage Library Panning,不同的是抗原库源于天然样本,而无法多次淘选和富集,导致存在一定的假阳性和假阴性。
4) Protein microarray,蛋白质芯片技术,根据抗原库来源不同分为两种
形式(Figure 9)16,一是反向蛋白质芯片(reverse protein microarray),即将特定抗体固定于芯片表面,首先捕获肿瘤组织或细胞系裂解液中的蛋白,再基于血清学高通量检测获得差异性或阳性蛋白,通过抗体的特异性确定抗原信息。它的优势在于,可以分析天然抗原和天然构象表位,但这种方法依赖于抗体的个数和质量,很难获得足够的抗原库。另外一种是是重组蛋白质芯片,即将确定的重组蛋白直接固定于芯片表面,进而进行血清学筛选,这是最直接的一种方式,同时满足高通量和大量样本筛选的需求。但是获得足够多种类的重组蛋白是一个瓶颈48。
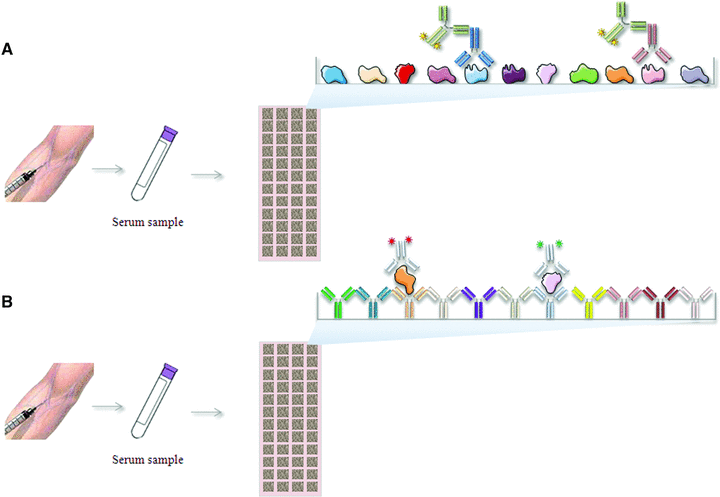
Figure 9 蛋白质芯片方法示意图16。A) 重组蛋白芯片,可直接进行血清学检测;B) 抗体芯片,先通过组织或细胞裂解液捕获抗原,再进行血清学检测。
而包含~20000 个重组蛋白,涵盖~75% 的人类蛋白质组的 HuProt™ 人类全蛋白质组芯片正是用于 TAA 发现的理想工具。
五、实施方案
5.1 实验原理
如 Figure 10 所示,每个血清样本,使用 1 张 HuProt™ 蛋白质芯片进行检测,特异性的抗体(包括 IgG、IgM)与固定于芯片上的蛋白进行结合,清洗去除未结合的抗体和其它蛋白质,再用抗人 IgM 荧光标记二抗(cy5 标记,呈现红色)和抗人 IgG 荧光二抗(cy3 标记,呈现绿色)检测,通过荧光扫描仪读取信号,信号的强弱与抗体的亲和力和数量呈正相关。。
而包含~20000 个重组蛋白,涵盖~75% 的人类蛋白质组的 HuProt™ 人类全蛋白质组芯片正是用于 TAA 发现的理想工具。
五、实施方案
5.1 实验原理
如 Figure 10 所示,每个血清样本,使用 1 张 HuProt™ 蛋白质芯片进行检测,特异性的抗体(包括 IgG、IgM)与固定于芯片上的蛋白进行结合,清洗去除未结合的抗体和其它蛋白质,再用抗人 IgM 荧光标记二抗(cy5 标记,呈现红色)和抗人 IgG 荧光二抗(cy3 标记,呈现绿色)检测,通过荧光扫描仪读取信号,信号的强弱与抗体的亲和力和数量呈正相关。。
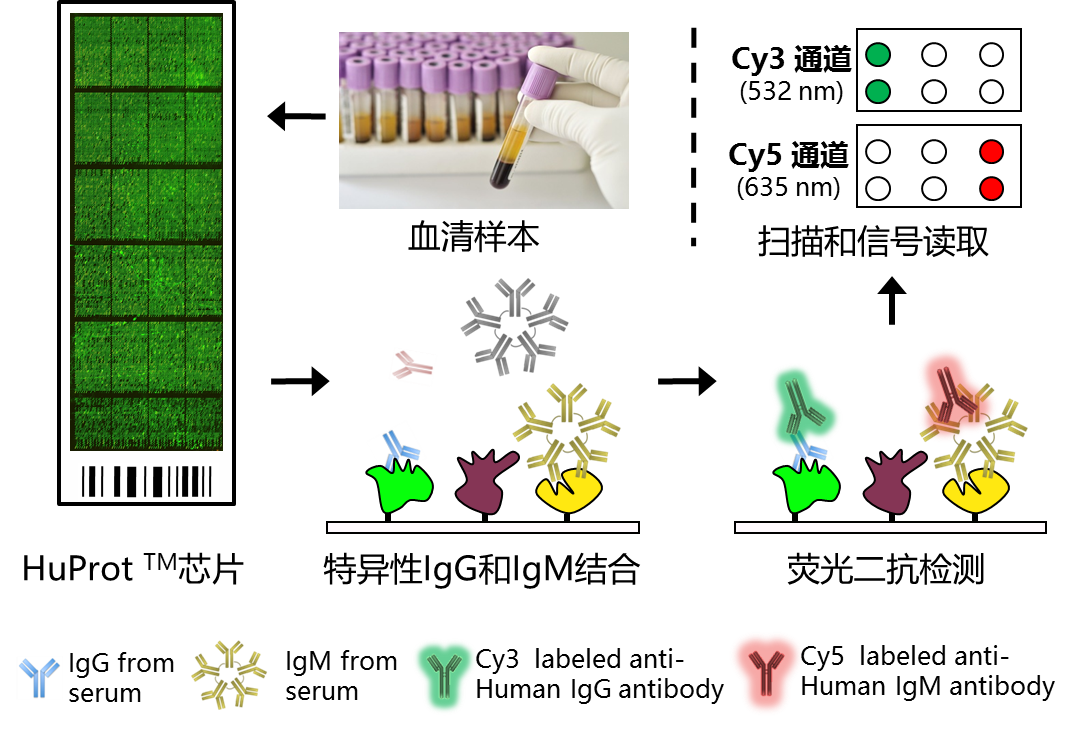
Figure 10 TEAMS 实验原理图,即基于蛋白质芯片进行血清学筛选的示意图。可同时检测两种抗体亚型(IgG 和 IgM)的结合情况,分别使用两种不同的荧光标记的特异性二抗进行鉴别。
5.2. 实施路线
针对某一特定肿瘤,实施路线图如 Figure 11 所示,实验分为两个阶段:
1. 发现阶段(Discovery Phage):
基于 HuProt™ 人类全蛋白质组芯片,各筛选 50 例肿瘤病人(不同分期)
和 50 例健康对照(年龄和性别匹配)。数据分析:每个蛋白单独分析,设置合适的 cutoff 值,计算肿瘤组阳性率,并计算 fold change 和 p value,确定 TAA 候选物。
通过蛋白质芯片筛选获得的初步候选 TAA,连同文献报道的 TAA,以及其它肿瘤筛选得到的 TAA,一并构建 Focused TAA Array。
5.2. 实施路线
针对某一特定肿瘤,实施路线图如 Figure 11 所示,实验分为两个阶段:
1. 发现阶段(Discovery Phage):
基于 HuProt™ 人类全蛋白质组芯片,各筛选 50 例肿瘤病人(不同分期)
和 50 例健康对照(年龄和性别匹配)。数据分析:每个蛋白单独分析,设置合适的 cutoff 值,计算肿瘤组阳性率,并计算 fold change 和 p value,确定 TAA 候选物。
通过蛋白质芯片筛选获得的初步候选 TAA,连同文献报道的 TAA,以及其它肿瘤筛选得到的 TAA,一并构建 Focused TAA Array。

Figure 11 TEAMS 实施路线图(某一肿瘤)。1) 发现阶段:使用 HuProt™ 人类全蛋白质组芯片进行初筛,肿瘤病人和健康对照样本数各 50 例;2) 候选标志物抗原,联合汇总的文献中比较好的肿瘤相关抗原(TAAs)制备 TAA Array;3) 大样本验证:首先是训练以获得能够区分健康对照、系统性红斑狼疮对照、相关疾病对照以及其它肿瘤的特异性标志物组合以及模型;然后采用独立样本进行客观评价。
2. 验证阶段(Validation Phase):分为 training 和 test 两部分。
1500 例样本:500 例疾病(不同分期)、500 例疾病对照、500 例健康对照,同时我们提供其余至少 5 种肿瘤的> 500 例样本和 > 200 例系统性红斑狼疮 (SLE) 的对照样本,进行 TAA array 的芯片实验;随机选择 750 例(250/250/250)疾病相关样本和 50% 其它肿瘤和 SLE 的样本进行训练(training):1) 评价各个 TAA 的特异性和灵敏性,2) 建立基于组合的诊断模型,以 ROC 作为评价。
在此模型之上,利用其余样本进行测试(test),直接评价特异性和灵敏度,并利用模型获得的数值进行 ROC 评价。
Reference:
1. Etzoni, R. et al. The case for early detection. Nat. Rev. Cancer 3, 243-252 (2003).
2. Hanash, S. M., Baik, C. S. & Kallioniemi, O. Emerging molecular biomarkers--blood-based strategies to detect and monitor cancer. Nat. Rev. Clin. Oncol. 8, 142-150 (2011).
3. Finn, O. J. & Ph, D. Immune Response as a Biomarker for Cancer Detection and a Lot More. N. Engl. J. Med. 1288-1290 (2012).
4. Wang, X. et al. Autoantibody signatures in prostate cancer. N. Engl. J. Med. 353, 1224-1235 (2005).
5. Baldwin, R. W. Tumour-specific immunity against spontneous rat tumours. Int. J. Cancer 1, 257-264 (1966).
6. Zaenker, P., Gray, E. S. & Ziman, M. R. Autoantibody Production in Cancer-The Humoral Immune Response toward Autologous Antigens in Cancer Patients. Autoimmun. Rev. 15, 477-483 (2016).
7. Konsoulova, A. in Immunopathology and Immunomodulation 78-99 (2015).
8. Caron, M., Choquet-Kastylevsky, G. & Joubert-Caron, R. Cancer immunomics using autoantibody signatures for biomarker discovery. Mol. Cell. Proteomics 6, 1115-1122 (2007).
9. Anderson, K. S. & LaBaer, J. The sentinel within: Exploiting the immune system for cancer biomarkers. J. Proteome Res. 4, 1123-1133 (2005).
10. Sharma, P. & Allison, J. P. The future of immune checkpoint therapy. Science (80-. ). 348, 56-61 (2015).
11. Julien, S., Videira, P. A. & Delannoy, P. Sialyl-tn in cancer: (how) did we miss the target? Biomolecules 2, 435-66 (2012).
12. Carmi, Y. et al. Allogeneic IgG combined with dendritic cell stimuli induce antitumour T-cell immunity. Nature 521, 99-104 (2015).
13. Shen, M. et al. Positive and negative functions of B lymphocytes in tumors. Oncotarget 5, (2016).
14. Casiano, C. A., Mediavilla-Varela, M. & Tan, E. M. Tumor-associated antigen arrays for the serological diagnosis of cancer. Mol. Cell. proteomics 5, 1745-59 (2006).
15. Zaenker, P. & Ziman, M. R. Serologic autoantibodies as diagnostic cancer biomarkers - A review. Cancer Epidemiol. Biomarkers Prev. 22, 2161-2181 (2013).
16. Desmetz, C., Mange, A., Maudelonde, T. & Solassol, J. Autoantibody signatures: Progress and perspectives for early cancer detection. J. Cell. Mol. Med. 15, 2013-2024 (2011).
17. Soussi, T. p53 Antibodies in the sera of patients with various types of cancer: a review. Cancer Res 60, 1777-88. (2000).
18. Crawford, L. V, Pim, D. C. & Bulbrook, R. D. Detection of antibodies against the cellular protein p53 in sera from patients with breast cancer. Int. J. Cancer 30, 403-8 (1982).
19. Lubin, R. et al. Serum p53 antibodies as early markers of lung cancer. Nat. Med. 1, 701-2 (1995).
20. Zalcman, G. et al. Monitoring of p53 autoantibodies in lung cancer during therapy: Relationship to response to treatment. Clin. Cancer Res. 4, 1359-1366 (1998).
21. Dai, L. et al. Autoantibodies against tumor-associated antigens in the early detection of lung cancer. Lung cancer 99, 172-9 (2016).
22. Veronesi, G., Bianchi, F., Infante, M. & Alloisio, M. The challenge of small lung nodules identified in CT screening: can biomarkers assist diagnosis? Biomark. Med. 10, 137-143 (2016).
23. Pan, X., Gao, Y., Liu, J., Liu, C. & Xia, Y. Progress in studies on autoantibodies against tumor-associated antigens in hepatocellular carcinoma. Transl. Cancer Res. 5, 845-859 (2016).
24. Hong, Y. & Huang, J. Autoantibodies against tumor-associated antigens for detection of hepatocellular carcinoma. World J. Hepatol. 7, 1581-5 (2015).
25. Yang, L. et al. Identification of Serum Biomarkers for Gastric Cancer Diagnosis Using a Human Proteome Microarray. Mol. Cell. Proteomics 15, 614-23 (2016).
26. Werner, S., Chen, H., Tao, S. & Brenner, H. Systematic review: Serum autoantibodies in the early detection of gastric cancer. Int. J. Cancer 136, 2243-2252 (2015).
27. Jenkinson, C. et al. Biomarkers for early diagnosis of pancreatic cancer. Expert Rev. Gastroenterol. Hepatol. 4124, 1-11 (2014).
28. Gnjatic, S. et al. Seromic profiling of ovarian and pancreatic cancer. Proc. Natl. Acad. Sci. U. S. A. 107, 5088-93 (2010).
29. Toye, A. M., Parsons, S. F., Anstee, D. J. & Frayne, J. Immunoseroproteomic Profiling in African American Men with Prostate Cancer: Evidence for an Autoantibody Response to Glycolysis and Plasminogen-Associated Proteins. Mol. Cell. Proteomics 1-28 (2016). doi:10.1074/mcp.M115.056358
30. Zhang, J. Y. et al. De-novo humoral immune responses to cancer-associated autoantigens during transition from chronic liver disease to hepatocellular carcinoma. Clin. Exp. Immunol. 125, 3-9 (2001).
31. Liu, M. et al. Autoantibody response to murine double minute 2 protein in immunodiagnosis of hepatocellular carcinoma. J. Immunol. Res. 2014, (2014).
32. Dai, L. et al. Using immunomic approach to enhance tumor-associated autoantibody detection in diagnosis of hepatocellular carcinoma. Clin. Immunol. 152, 127-139 (2014).
33. Zhang, J. Y., Chan, E. K., Peng, X. X. & Tan, E. M. A novel cytoplasmic protein with RNA-binding motifs is an autoantigen in human hepatocellular carcinoma. J. Exp. Med. 189, 1101-10 (1999).
34. Zhang, J.-Y. et al. Antibody detection using tumor-associated antigen mini-array in immunodiagnosing human hepatocellular carcinoma. J. Hepatol. 46, 107-114 (2007).
35. Jett, J. R. et al. Audit of the autoantibody test, EarlyCDT?-Lung, in 1600 patients: An evaluation of its performance in routine clinical practice. Lung Cancer 83, 51-55 (2014).
36. Chapman, C. J. et al. EarlyCDT?-Lung test: Improved clinical utility through additional autoantibody assays. Tumor Biol. 33, 1319-1326 (2012).
37. http://www.eclsstudy.org/.
38. https://www.provistadx.com/clinical-results.
39. Zhu, H. Global Analysis of Protein Activities Using Proteome Chips. Science (80-. ). 293, 2101-2105 (2001).
40. Hu, S. et al. A protein chip approach for high-throughput antigen identification and characterization. Proteomics 7, 2151-2161 (2007).
41. Jeong, J. S. et al. Rapid identification of monospecific monoclonal antibodies using a human proteome microarray. Mol. Cell. Proteomics 11, O111.016253 (2012).
42. Hu, C.-J. et al. Identification of new autoantigens for primary biliary cirrhosis using human proteome microarrays. Mol. Cell. Proteomics 11, 669-680 (2012).
43. Hu, C. et al. Autoantibody profiling on human proteome microarray for biomarker discovery in cerebrospinal fluid and sera of neuropsychiatric lupus. PLoS One 10, e0126643 (2015).
44. Hu, C.-J. et al. Identification of Novel Biomarkers for Behcet Disease Diagnosis Using Human Proteome Microarray Approach. Mol. Cell. Proteomics 16, 147-156 (2017).
45. Syed, P. et al. Autoantibody Profiling of Glioma Serum Samples to Identify Biomarkers Using Human Proteome Arrays. Sci Rep 5, 13895 (2015).
46. Heo, C. K., Bahk, Y. Y. & Cho, E. W. Tumor-associated autoantibodies as diagnostic and prognostic biomarkers. BMB Rep. 45, 677-685 (2012).
47. Sahin, U. et al. Human neoplasms elicit multiple specific immune responses in the autologous host. Proc. Natl. Acad. Sci. U. S. A. 92, 11810-11813 (1995).
48. Tan, H. T., Low, J., Lim, S. G. & Chung, M. C. M. Serum autoantibodies as biomarkers for early cancer detection. FEBS J. 276, 6880-6904 (2009).
49. Liu, H. et al. Screening of autoantibodies as potential biomarkers for hepatocellular carcinoma by using T7 phase display system. Cancer Epidemiol. 36, 82-88 (2012).
2. 验证阶段(Validation Phase):分为 training 和 test 两部分。
1500 例样本:500 例疾病(不同分期)、500 例疾病对照、500 例健康对照,同时我们提供其余至少 5 种肿瘤的> 500 例样本和 > 200 例系统性红斑狼疮 (SLE) 的对照样本,进行 TAA array 的芯片实验;随机选择 750 例(250/250/250)疾病相关样本和 50% 其它肿瘤和 SLE 的样本进行训练(training):1) 评价各个 TAA 的特异性和灵敏性,2) 建立基于组合的诊断模型,以 ROC 作为评价。
在此模型之上,利用其余样本进行测试(test),直接评价特异性和灵敏度,并利用模型获得的数值进行 ROC 评价。
Reference:
1. Etzoni, R. et al. The case for early detection. Nat. Rev. Cancer 3, 243-252 (2003).
2. Hanash, S. M., Baik, C. S. & Kallioniemi, O. Emerging molecular biomarkers--blood-based strategies to detect and monitor cancer. Nat. Rev. Clin. Oncol. 8, 142-150 (2011).
3. Finn, O. J. & Ph, D. Immune Response as a Biomarker for Cancer Detection and a Lot More. N. Engl. J. Med. 1288-1290 (2012).
4. Wang, X. et al. Autoantibody signatures in prostate cancer. N. Engl. J. Med. 353, 1224-1235 (2005).
5. Baldwin, R. W. Tumour-specific immunity against spontneous rat tumours. Int. J. Cancer 1, 257-264 (1966).
6. Zaenker, P., Gray, E. S. & Ziman, M. R. Autoantibody Production in Cancer-The Humoral Immune Response toward Autologous Antigens in Cancer Patients. Autoimmun. Rev. 15, 477-483 (2016).
7. Konsoulova, A. in Immunopathology and Immunomodulation 78-99 (2015).
8. Caron, M., Choquet-Kastylevsky, G. & Joubert-Caron, R. Cancer immunomics using autoantibody signatures for biomarker discovery. Mol. Cell. Proteomics 6, 1115-1122 (2007).
9. Anderson, K. S. & LaBaer, J. The sentinel within: Exploiting the immune system for cancer biomarkers. J. Proteome Res. 4, 1123-1133 (2005).
10. Sharma, P. & Allison, J. P. The future of immune checkpoint therapy. Science (80-. ). 348, 56-61 (2015).
11. Julien, S., Videira, P. A. & Delannoy, P. Sialyl-tn in cancer: (how) did we miss the target? Biomolecules 2, 435-66 (2012).
12. Carmi, Y. et al. Allogeneic IgG combined with dendritic cell stimuli induce antitumour T-cell immunity. Nature 521, 99-104 (2015).
13. Shen, M. et al. Positive and negative functions of B lymphocytes in tumors. Oncotarget 5, (2016).
14. Casiano, C. A., Mediavilla-Varela, M. & Tan, E. M. Tumor-associated antigen arrays for the serological diagnosis of cancer. Mol. Cell. proteomics 5, 1745-59 (2006).
15. Zaenker, P. & Ziman, M. R. Serologic autoantibodies as diagnostic cancer biomarkers - A review. Cancer Epidemiol. Biomarkers Prev. 22, 2161-2181 (2013).
16. Desmetz, C., Mange, A., Maudelonde, T. & Solassol, J. Autoantibody signatures: Progress and perspectives for early cancer detection. J. Cell. Mol. Med. 15, 2013-2024 (2011).
17. Soussi, T. p53 Antibodies in the sera of patients with various types of cancer: a review. Cancer Res 60, 1777-88. (2000).
18. Crawford, L. V, Pim, D. C. & Bulbrook, R. D. Detection of antibodies against the cellular protein p53 in sera from patients with breast cancer. Int. J. Cancer 30, 403-8 (1982).
19. Lubin, R. et al. Serum p53 antibodies as early markers of lung cancer. Nat. Med. 1, 701-2 (1995).
20. Zalcman, G. et al. Monitoring of p53 autoantibodies in lung cancer during therapy: Relationship to response to treatment. Clin. Cancer Res. 4, 1359-1366 (1998).
21. Dai, L. et al. Autoantibodies against tumor-associated antigens in the early detection of lung cancer. Lung cancer 99, 172-9 (2016).
22. Veronesi, G., Bianchi, F., Infante, M. & Alloisio, M. The challenge of small lung nodules identified in CT screening: can biomarkers assist diagnosis? Biomark. Med. 10, 137-143 (2016).
23. Pan, X., Gao, Y., Liu, J., Liu, C. & Xia, Y. Progress in studies on autoantibodies against tumor-associated antigens in hepatocellular carcinoma. Transl. Cancer Res. 5, 845-859 (2016).
24. Hong, Y. & Huang, J. Autoantibodies against tumor-associated antigens for detection of hepatocellular carcinoma. World J. Hepatol. 7, 1581-5 (2015).
25. Yang, L. et al. Identification of Serum Biomarkers for Gastric Cancer Diagnosis Using a Human Proteome Microarray. Mol. Cell. Proteomics 15, 614-23 (2016).
26. Werner, S., Chen, H., Tao, S. & Brenner, H. Systematic review: Serum autoantibodies in the early detection of gastric cancer. Int. J. Cancer 136, 2243-2252 (2015).
27. Jenkinson, C. et al. Biomarkers for early diagnosis of pancreatic cancer. Expert Rev. Gastroenterol. Hepatol. 4124, 1-11 (2014).
28. Gnjatic, S. et al. Seromic profiling of ovarian and pancreatic cancer. Proc. Natl. Acad. Sci. U. S. A. 107, 5088-93 (2010).
29. Toye, A. M., Parsons, S. F., Anstee, D. J. & Frayne, J. Immunoseroproteomic Profiling in African American Men with Prostate Cancer: Evidence for an Autoantibody Response to Glycolysis and Plasminogen-Associated Proteins. Mol. Cell. Proteomics 1-28 (2016). doi:10.1074/mcp.M115.056358
30. Zhang, J. Y. et al. De-novo humoral immune responses to cancer-associated autoantigens during transition from chronic liver disease to hepatocellular carcinoma. Clin. Exp. Immunol. 125, 3-9 (2001).
31. Liu, M. et al. Autoantibody response to murine double minute 2 protein in immunodiagnosis of hepatocellular carcinoma. J. Immunol. Res. 2014, (2014).
32. Dai, L. et al. Using immunomic approach to enhance tumor-associated autoantibody detection in diagnosis of hepatocellular carcinoma. Clin. Immunol. 152, 127-139 (2014).
33. Zhang, J. Y., Chan, E. K., Peng, X. X. & Tan, E. M. A novel cytoplasmic protein with RNA-binding motifs is an autoantigen in human hepatocellular carcinoma. J. Exp. Med. 189, 1101-10 (1999).
34. Zhang, J.-Y. et al. Antibody detection using tumor-associated antigen mini-array in immunodiagnosing human hepatocellular carcinoma. J. Hepatol. 46, 107-114 (2007).
35. Jett, J. R. et al. Audit of the autoantibody test, EarlyCDT?-Lung, in 1600 patients: An evaluation of its performance in routine clinical practice. Lung Cancer 83, 51-55 (2014).
36. Chapman, C. J. et al. EarlyCDT?-Lung test: Improved clinical utility through additional autoantibody assays. Tumor Biol. 33, 1319-1326 (2012).
37. http://www.eclsstudy.org/.
38. https://www.provistadx.com/clinical-results.
39. Zhu, H. Global Analysis of Protein Activities Using Proteome Chips. Science (80-. ). 293, 2101-2105 (2001).
40. Hu, S. et al. A protein chip approach for high-throughput antigen identification and characterization. Proteomics 7, 2151-2161 (2007).
41. Jeong, J. S. et al. Rapid identification of monospecific monoclonal antibodies using a human proteome microarray. Mol. Cell. Proteomics 11, O111.016253 (2012).
42. Hu, C.-J. et al. Identification of new autoantigens for primary biliary cirrhosis using human proteome microarrays. Mol. Cell. Proteomics 11, 669-680 (2012).
43. Hu, C. et al. Autoantibody profiling on human proteome microarray for biomarker discovery in cerebrospinal fluid and sera of neuropsychiatric lupus. PLoS One 10, e0126643 (2015).
44. Hu, C.-J. et al. Identification of Novel Biomarkers for Behcet Disease Diagnosis Using Human Proteome Microarray Approach. Mol. Cell. Proteomics 16, 147-156 (2017).
45. Syed, P. et al. Autoantibody Profiling of Glioma Serum Samples to Identify Biomarkers Using Human Proteome Arrays. Sci Rep 5, 13895 (2015).
46. Heo, C. K., Bahk, Y. Y. & Cho, E. W. Tumor-associated autoantibodies as diagnostic and prognostic biomarkers. BMB Rep. 45, 677-685 (2012).
47. Sahin, U. et al. Human neoplasms elicit multiple specific immune responses in the autologous host. Proc. Natl. Acad. Sci. U. S. A. 92, 11810-11813 (1995).
48. Tan, H. T., Low, J., Lim, S. G. & Chung, M. C. M. Serum autoantibodies as biomarkers for early cancer detection. FEBS J. 276, 6880-6904 (2009).
49. Liu, H. et al. Screening of autoantibodies as potential biomarkers for hepatocellular carcinoma by using T7 phase display system. Cancer Epidemiol. 36, 82-88 (2012).












