结核杆菌如何导致结核病?蛋白质芯片揭示其致病途径
发布时间:2022-10-21 14:43 | 点击次数:
上期回顾
文中两支科研团队都借助体必康科研平台,构建并利用结核杆菌蛋白质组芯片,结合ELISA验证筛选出了一系列高灵敏度、高特异性的蛋白标志物,为区分结核潜伏感染和活动性结核病提供了良好诊断方案,能在一定程度上推动结核病的控制和消除。
查看上期:《结核病临床诊断标志物筛选难?缺的是1张蛋白质芯片!》
引言
结核病是由结核杆菌(Mycobacterium tuberculosis, Mtb)感染引起的一种严重危害人类健康的慢性传染病,全人群易感。世界卫生组织发布的《2021年全球结核病报告》显示,2020年全球新发结核病患者约987万,死于结核病的患者约150万。结核杆菌成功感染宿主需多个阶段,包括:在巨噬细胞中成功繁殖、修饰宿主免疫反应、在宿主中持续存在并保留被激活的潜力。
结核杆菌在与宿主免疫对抗过程中进化出了多种机制,既可以逃逸宿主免疫攻击,又可以启动抗结核免疫反应以维持对宿主的慢性感染。但至今结核杆菌引起宿主感染的调控机制仍不明确,而对结核杆菌与宿主间相互作用机制的深入研究,可以为研制新型疫苗和发掘新型抗结核药物靶标奠定坚实基础。
蛋白质芯片是将某一物种的所有蛋白质固定在特定修饰的固相载体上而集成的微阵列,已被广泛应用于蛋白相互作用研究中,以其全局性、系统性的优势提供全局视角,为结核杆菌基础研究提供了更高效的研究方法。
一、研究背景
磷酸化在真核生物和原核生物的信号转导中发挥着重要作用,特别是丝氨酸/苏氨酸蛋白激酶(STPK),是真核生物中最主要的一类蛋白激酶家族。越来越多的研究发现,STPK在调控多种环境变化、细胞壁合成、细胞分化以及病原-宿主互作中起到了至关重要的作用。结核杆菌含有11种真核类STPK。到目前为止,研究人员已发现了少量与激酶相互作用的结核杆菌蛋白质,但这些已知的相互作用完全不足以系统地解释STPK对结核杆菌的复杂调控作用。
为更加系统地了解STPK在结核杆菌中发挥的作用,上海交通大学系统生物医学研究院陶生策研究团队利用MtbProt®结核杆菌全蛋白质组芯片(体必康科研服务平台提供),鉴定了所有与STPK结合的结核杆菌蛋白,构建了第一个STPK蛋白相互作用(KPI)网络。该项研究为了解结核杆菌关键信号通路提供新思路,在促进药物开发和有效控制结核杆菌感染中发挥了重要作用。该研究成果在《Molecular & Cellular Proteomics》上发表。

权威期刊在线发表
二、研究思路

项目研究思路展示
三、研究结果
1、结核杆菌STPK互作蛋白全局性筛选
研究人员首先纯化获得11个结核杆菌STPK,银染实验结果及磷酸化检测结果显示每个激酶的蛋白分子量正确,活性良好。利用MtbProt®结核杆菌全蛋白质组芯片筛选出与每个激酶相互作用的结核杆菌蛋白,最终筛选出492个结合蛋白,鉴定出1027个STPK与结核蛋白相互作用。其中,超过53%(262/492)的结核蛋白仅与一种激酶特异性相互作用,其余蛋白质与2种或以上激酶相互作用。以上结果表明,STPKs不仅有其独特性,还保留了某些蛋白质组的共性,这与已有文献结论一致。据我们所知,本研究是第一个最全面的结核杆菌STPK蛋白相互作用网络。

利用MtbProt®结核杆菌全蛋白质组芯片筛选与STPK互作的蛋白
为了证明这些STPK的作用,研究团队对STPK相互作用蛋白进行GO分析,并基于功能对11种STPKs进行聚类分析。结果显示,STPK在调控细胞代谢及膜相关功能中发挥重要作用。

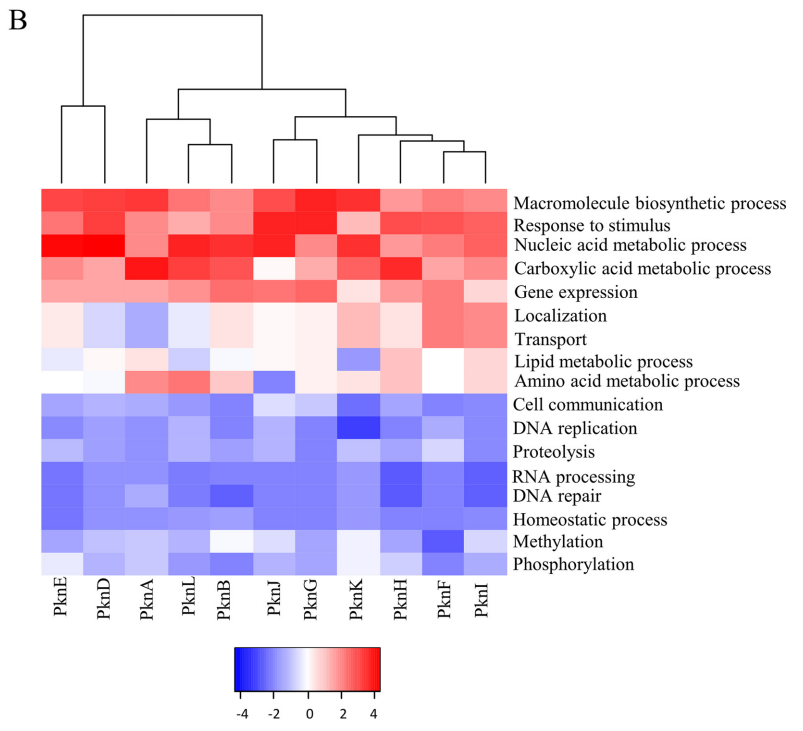
A:GO分析STPK相互作用蛋白;
B:11种STPK基于功能的聚类分析
2、STPK-蛋白互作验证
为进一步验证激酶-蛋白相互作用,研究人员利用生物膜干涉法(BLI)和酵母双杂交(Y2H)分析验证随机挑选的80组STPK-蛋白(经过Mtb蛋白质组芯片鉴定)。结果显示成功验证了33个蛋白的相互作用,提示利用MtbProt®结核杆菌全蛋白质组芯片筛选的相互作用蛋白是可靠的。

生物膜干涉法(BLI)和酵母双杂交(Y2H)验证STPK-蛋白相互作用
A,B:BLI和Y2H验证PknB的关键因素;
C,D:BLI和Y2H验证PknD的关键因素;
E:BLI和Y2H验证成功率。
注:“+”代表有相互作用,“++”代表有较强的相互作用
3、STPK与互作蛋白功能验证
研究人员对互作蛋白进行体外磷酸化实验,通过质谱检测磷酸化情况,以进一步验证激酶-底物关系的有效性。结果显示,STPK可以磷酸化相互作用底物蛋白,且苏氨酸磷酸化修饰比丝氨酸磷酸化修饰更丰富,PknB使WbbL2酪氨酸位点磷酸化等结果也与已发表文献结论一致。

STPK磷酸化底物蛋白验证
注:通过加入STPK和纯化的相互作用蛋白进行磷酸化反应;包括四种代表性的STPK,即PknB、PknD、PknG和PknH,每个STPK用随机选择的相互作用蛋白进行磷酸化反应,不含ATP的反应作为阴性对照;然后对蛋白质进行质谱分析,以确定磷酸化丝氨酸/苏氨酸位点。
4、构建STPK-蛋白相互作用网络
为更加系统地理解STPK与底物蛋白间的关系,研究人员利用STRING分析和CYTOSCAPE构建了STPK-蛋白相互作用网络,其中不同颜色代表不同的生物过程。STPK-蛋白相互作用网络显示,大部分蛋白涉及细胞壁脂肪合成代谢过程、氨基酸代谢过程和核苷酸代谢过程。
构建结核杆菌STPK的相互作用网络,更便于我们识别STPK关键绩效指标之间高度关联的相互作用,从而扩展了我们对涉及STPK的关键细胞功能范围的理解。

STPK相互作用功能蛋白网络
5、STPK作用机制阐释-PknG促进MurC的活性来调控细胞壁的合成
基于PknG不仅可以直接干涉宿主细胞内自身的信号传导机制,还可以调控谷氨酸代谢过程,进而间接影响结核杆菌毒性的特点,研究团队选择对PknG进行更详细的功能验证。研究人员利用体外磷酸化实验测定PknG对MurC的磷酸化作用,通过质谱鉴定其磷酸化位点。结果显示,PknG可以促进MurC的活性。

PknG与MurC相互作用调节MurC酶活性
A:Mur酶形成PG;
B:BLI体外验证PknG和MurC相互作用;
C:PknG体外磷酸化MurC;
D:Co-IP验证PknG与MurC相互作用;
E:高效液相质谱体内验证MurC活性。
为进一步验证PknG过表达对细胞表型的影响,研究团队通过观察生物膜形成情况来看PknG的影响。结果显示,PknG不仅可以提高细胞壁的厚度,还可以通过促进MurC的活性来增加细胞壁成分的含量进而稳定细胞壁结构。

PknG调控细胞壁的合成
A:PknG过表达来检测抗酸染色情况;
B:PknG促进生物膜形成,不同时间下观察液体表面的生物膜形成情况。
四、总结
该项研究利用MtbProt®结核杆菌全蛋白质组芯片系统性、特异性和全局性的特点,筛选获得与STPK相互作用的结核杆菌蛋白,构建了STPK-结核杆菌蛋白相互作用网络,有助于结核杆菌调节途径和功能活性研究、筛选新药物靶点以及开发结核杆菌特异性药物。
体必康集团依托中国科学院生物物理研究所搭建了科研平台,沉淀并转化了一系列蛋白质组学技术(从基因克隆、载体构建、蛋白表达,到芯片制备、样本检测及分析报告等一系列标准化、专业化、工业化的蛋白质芯片研发和服务技术),得到了行业的广泛认可。除此之外,体必康科研平台还提供其他组学技术服务,如质谱、测序等。
体必康科研以健康中国为己任,致力于“让临床科研不再难”,不仅提供单一的组学技术服务,还提供解决临床问题的整体研究方案,与临床医生一起,从临床问题出发,系统全面地解析生命过程的发生、发展机制。
参考文献
Wu, F. L., Liu, Y., Jiang, H. W. et al. The Ser/Thr Protein Kinase Protein-Protein Interaction Map of M.tuberculosis. Molecular and Cellular Proteomics.16(8),1491-1506(2017).
图片来源
参考文献
本文作者:黄贞贞
下期预告
在抗结核治疗研究中,我们除了需要了解结核杆菌自身的机制通路,还需明确结核杆菌的耐药机制。MtbProt®结核杆菌全蛋白质组芯片,又是如何作用于探究结核杆菌耐药性的发生发展及其分子机制呢?












