亨廷顿病治疗新曙光!小分子芯片助力自噬偶联化合物的筛选
发布时间:2023-07-19 16:14 | 点击次数:
上期回顾
复旦大学研究团队通过小分子芯片等技术,为针对“不可成药”靶蛋白大规模药物筛选提供了一种新的模式:首先筛选致病靶蛋白的直接结合化合物,然后根据化合物对疾病模型治疗效果进行表型筛选,并通过相应的表型和机制研究明确作用机理。
导语
传统药物靶标(比如激酶等)是小分子药物研究的主方向,但是随着技术的发展和进步,药物研究也慢慢从传统药物靶标转向更具挑战的“不可成药靶标”。这些靶标通常是缺乏明确的配体结合口袋、晶体结构研究极少等的蛋白质,约占人体蛋白质的80%,对于疾病的治疗具有关键作用。目前,关于靶向“不可成药靶点”的核心是利用细胞自身的蛋白质降解系统(例如泛素-蛋白酶体途径、自噬-溶酶体途径等),标记选定目标蛋白质并触发降解机制,如PROTAC、ATTEC、LYTAC等靶向降解技术,其主流思路也是集中在设计或发现双功能降解剂的靶向降解技术。
体必康科研平台的小分子微阵列芯片(Small molecule microarray,SMM),是将不同小分子药物(或待筛选化合物)集成在固相载体上形成微阵列,也称为药物小分子芯片。该芯片包含3375种小分子化合物(其中,1053种为中药单体、1527种为FDA批准的药物、795种为小分子抑制剂),可用于“可成药靶点”、“不可成药靶点”的配体化合物筛选,是靶向药物开发中的有力工具。
01、研究背景
亨廷顿病(HD)是典型的神经退行性疾病,临床上表现为运动障碍、认知障碍、精神异常等,患者一般在起病后10-15年死亡。而目前临床上对HD无任何治本疗法,仅能暂时缓解症状。神经细胞内大量突变的亨廷顿蛋白(mHTT)的累积,是引发HD的主要原因,因此降低致病蛋白mHTT的水平有望治疗HD。但目前mHTT生化活性未知,无法靶向,传统依靠阻断剂以阻断致病蛋白活性的方法并不适用。
复旦大学生命科学学院鲁伯埙教授课题组开创性地提出了基于自噬小体绑定化合物(ATTEC)的药物研发原创概念,通过小分子芯片(SMM)的筛选,发现了特异性结合亨廷顿病致病蛋白(mHTT)的小分子化合物,并通过将mHTT靶向自噬体进行降解以降低mHTT表达水平,有望为亨廷顿病的临床治疗带来新曙光。相关研究成果已在《Nature》上发表。

权威期刊在线发表
02、研究思路

03、研究结果
3.1mHTT–LC3偶联化合物筛选
为识别与mHTT–LC3选择性相互作用的化合物,研究团队将重组人LC3B蛋白、包含多聚谷氨酰胺的突变HTT蛋白(mHTT)和野生型HTT蛋白(wtHTT)与小分子芯片(SMM)孵育(图1a),鉴定出了10O5和8F20两种化合物与LC3和mHTT相互作用,但与野生型HTT蛋白无相互作用(图1b)。
10O5和8F20结构不同(图1c),但是具有相似的化学基团(一个芳基环),并且与mTT和LC3B结合域相似。因此,可以根据共同的结合域,额外筛选出mHTT-LC3偶联化合物AN1和AN2。
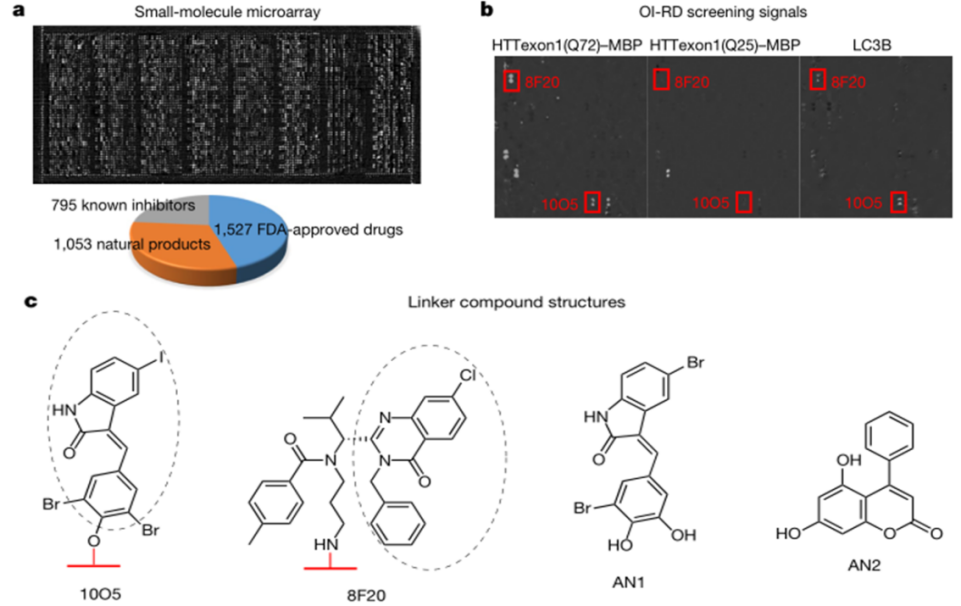
图1 | 基于SMM的筛选和验证鉴定潜在的mHTT-LC3偶联化合物
3.2偶联化合物特异性降低mHTT的验证
为验证这些mHTT-LC3偶联化合物是否如预测般通过自噬降低mHTT水平,研究团队在HD患者的成纤维细胞实验验证中发现,化合物10O5和8F20能以剂量依赖性地降低细胞内mHTT水平,但在健康人或帕金森氏病患者的成纤维细胞中wtHTT没有受影响(图2)。
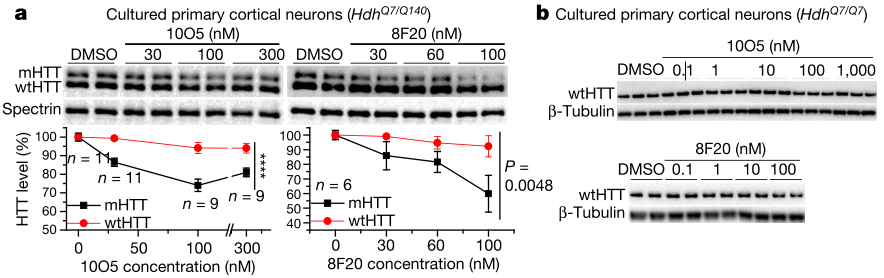
图2 | 偶联化合物特异性结合mHTT
为进一步证实自噬降解的作用,研究人员测试了化合物在降低或不降低ATG5(自噬体形成所需的关键自噬基因)的作用。HD患者成纤维细胞中的ATG5敲低,显著降低了LC3-II水平,并抵消了由mHTT-LC3偶联化合物诱导的降低mHTT的作用。在ATG5基因敲除小鼠胚胎成纤维细胞中获得了相似的结果,证实了化合物的作用是通过自噬降解介导的。同时,鉴于果蝇LC3同源物Atg8具有与LC3B高度相似的预测结构,研究人员在表达人类全长mHTT的HD转基因果蝇模型中测试了这些化合物。结果发现,4种mHTT-LC3偶联化合物在果蝇中均显著降低了mHTT水平,验证了这些化合物的体内作用。(图3)

图3 | mHTT-LC3偶联化合物能降低mHTT蛋白水平
3.3偶联化合物作用机制研究
基于偶联化合物能特异性降低mHTTs蛋白水平,研究团队进一步探究了其作用机制。体外pull-down实验的结果显示,注射10O5和AN2后显著增强了mHTT-LC3的相互作用,而wtHTT-LC3相互作用没有受影响(图4a,b)。通过观察瞬时转染GFP–LC3B和HTTexon1–MBP–His片段后的HeLa细胞状态(图4c),以及表达内源性LC3和全长mHTT蛋白的小鼠纹状体细胞(STHdhQ111/Q111)的变化(图4d),研究人员发现这些化合物会导致自噬体吞噬的mHTT增加。这些实验结果可以证实偶联化合物偶联了mHTT、LC3B和自噬体,特异性地将mHTT靶向自噬体,以降低mHTT水平。
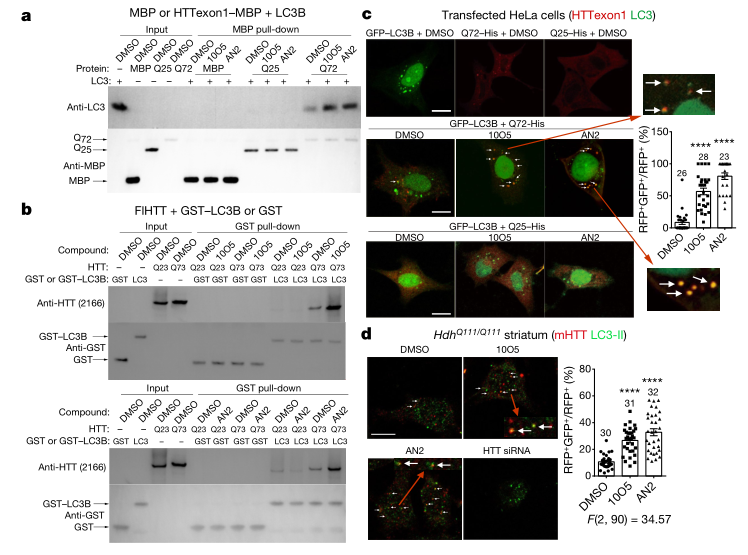
图4 | 偶联化合物增强mHTT-LC3互作并将mHTT与自噬体连接
3.4药物治疗潜力研究
研究发现,偶联化合物可以改善表达人源mHTT的果蝇与HD相关的行为缺陷,并延长其寿命,而对表达wtHTT的果蝇没有影响。在杂合性HD敲入小鼠(HdhQ7/Q140)模型中也观察到,腹腔注射10O5或AN2可以显著改善与HD相关的行为缺陷,而不会影响野生型小鼠,这表明化合物可改善与HD相关的表型(图5)。因此,可以证实化合物10O5、8F20、AN1和AN2具有治疗HD的潜力。
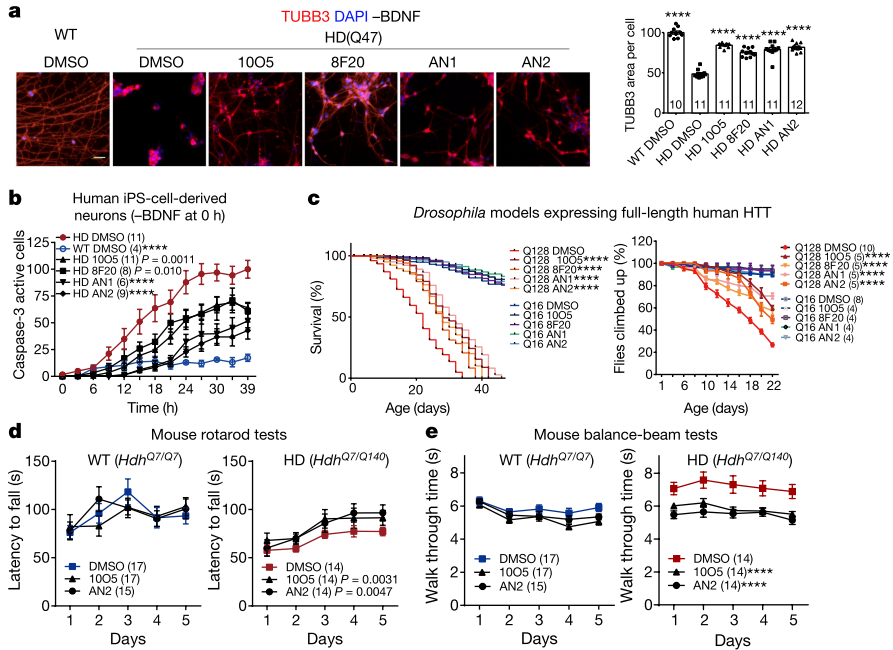
图5 | 偶联化合物在细胞和体内改善HD相关表型
04总结
直接运用小分子阻断或抑制致病蛋白的传统方法行不通时,该研究团队另辟蹊径,着眼于细胞自噬这一细胞内蛋白降解途径以有效降低变异亨廷顿蛋白水平。在自噬过程中,关键蛋白LC3被脂化后聚合扩增,形成膜结构,并将蛋白、脂类、细胞器等降解目标包裹于其中,形成完整的自噬小体(autophagosome),与溶酶体融合后,其中包裹的物质得以降解。
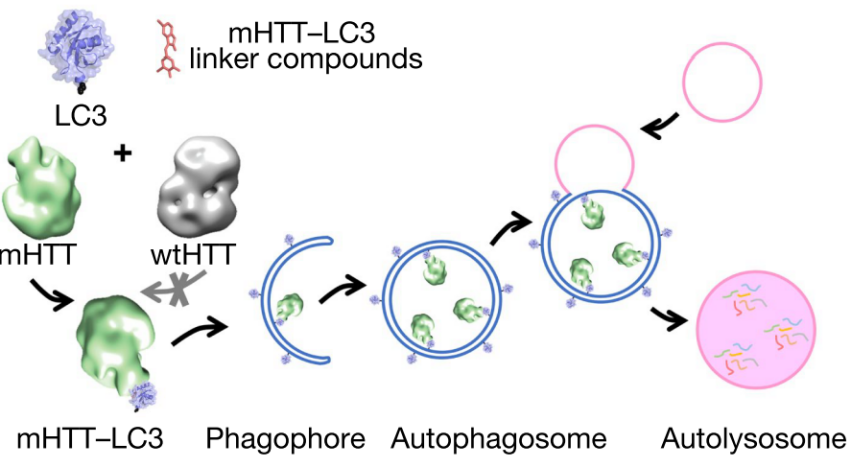
细胞自噬“吞没”致病蛋白mHTT的原理图
这项研究筛选出了特异性结合mHTT和LC3的小分子化合物,通过相互作用降低mHTT水平,为HD治疗提供了候选化合物;也证明了使用自噬体偶联化合物将蛋白质靶向降解的可能性,为药物发现提供了新的切入点。
体必康集团依托中国科学院生物物理研究所搭建了科研平台,沉淀并转化了一系列蛋白质组学技术(从基因克隆、载体构建、蛋白表达,到芯片制备、样本检测及分析报告等一系列标准化、专业化、工业化的蛋白质芯片研发和服务技术),得到了行业的广泛认可。除此之外,体必康科研平台还提供其他组学技术服务,如质谱、测序等。
体必康科研以健康中国为己任,致力于“让临床科研不再难”,不仅提供单一的组学技术服务,还可以根据研究方向定制合适的动物研究模型,提供动物实验技术服务,并将分子细胞乃至动物实验等多项技术整合,为解决临床问题提供整体研究方案。与临床医生一起,从临床问题出发,系统全面地解析生命过程的发生、发展机制。
参考文献
Zhaoyang Li, et al., Allele-selective Lowering of Mutant HTT Protein by HTT-LC3 Linker Compounds. Nature.30 October 2019.
图片来源
参考文献
撰稿:戴棚













